与竞争法相比小分子免疫检测夹心法的优势在哪里?
药物、环境污染物、化学污染物等小分子物质的检测是临床诊断、环境监测、食品分析等领域的重要课题。几十年来,免疫检测作为一种敏感、直接、经济的测量分析系统,一直是目标分析物可量化测量的支柱。免疫检测通常分为两大类,竞争法和非竞争法,非竞争法中最常用的就是夹心法。竞争免疫检测与夹心免疫检测,两者在检测原理、分析性能上有着本质性差异。在竞争免疫检测中,分析物与标记的(或固定的)分析物竞争有限的特异性抗体。相反,夹心免疫检测可以结合基于过量存在的两种不同抗体的分析物,赋予更高水平的灵敏度、精度和特异性。
1.检测原理差异
竞争免疫检测原理
在竞争免疫测定中,通常只采用一株抗体,且反应体系中抗体数量相对于待测物质数量是有限或不足的。示踪剂通过标记目标分析物的类似物进行制备,示踪剂与样本中的待测物共同竞争有限数量的抗体结合位点,被捕获示踪剂的数量与样本中分析物的浓度成反比关系。
夹心免疫检测原理
在夹心免疫测定中,通常采用两株抗体,可与分析物形成“三明治夹心”结构。其中一株抗体被固定在固相载体上,用于从样本中捕获分析物,另一株抗体特异性识别分析物的另一位点,用于构建信号生成系统,产生检测信号。产生的信号强度与样本中分析物浓度存在一定的正比关系。
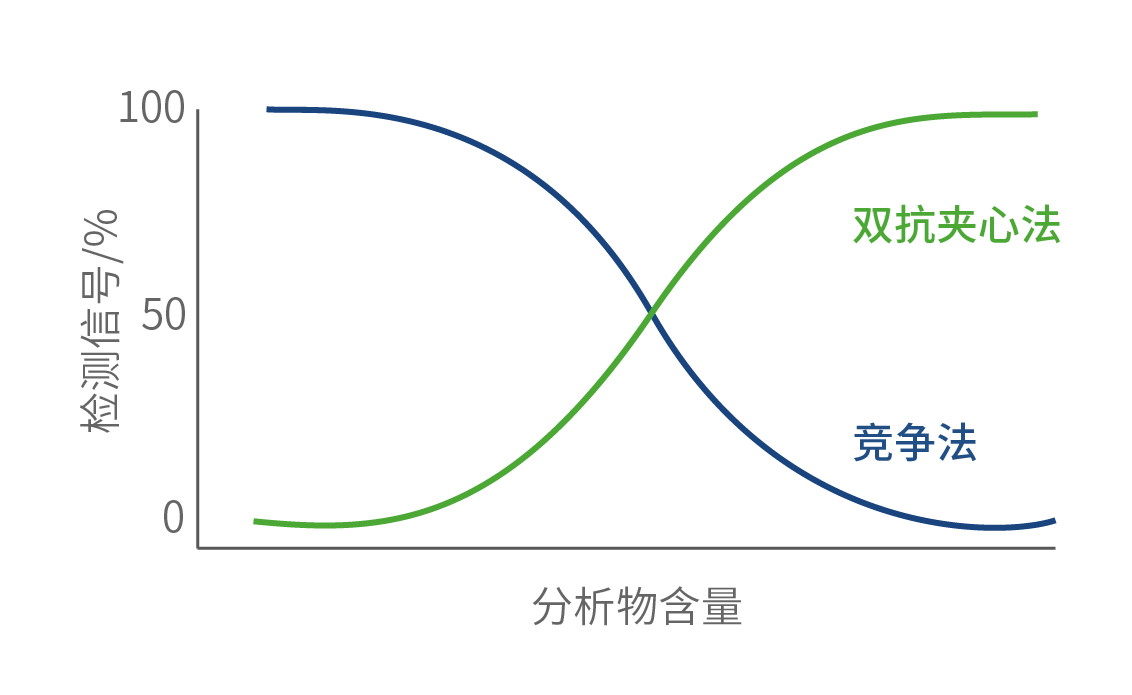
表1.夹心与竞争免疫检测的原理差异
| 检测方法 | 夹心法 | 竞争法 |
| 试剂用量 | 试剂过量 | 试剂限量 |
| 抗体株数 | 识别位点不同的两株抗体 | 一株抗体 |
| 信号强度 | 与分析物浓度成正比 | 与分析物浓度成反比 |
| 信号响应 |
|
|
| 检测结果 | 反映被分析物占用 的抗体结合位点数量 |
反映未被分析物占用 的抗体结合位点数量 |
竞争法灵敏度主要取决于抗体的结合能力(平衡常数),夹心法灵敏度受平衡常数的影响较低,灵敏度主要取决于分析物存在时的信号增益幅度和分析物不存在时的测量误差。从信号响应曲线来看,夹心法与竞争法产生钩状效应的位置不同,夹心法钩状效应发生在抗体高剂量时,竞争法则发生在抗体低剂量时。一般来说,在低背景下测量强信号要比测量两个弱信号之间的差异容易得多。基于这个原因,夹心法理论上具备比竞争法更高的灵敏度。此外,在动力学方面过量使用捕获和示踪抗体,有利于抗体-抗原-抗体复合物的形成,从而提高敏感性。
2.小分子免疫检测夹心法优势的实践研究
中国农业大学研究团队在开展小分子夹心免疫检测中分析物最小表位距离的研究中,比较了夹心和竞争免疫检测对不同表位距离模式分析物的检出限(LOD)、检测范围及特异性。发现在合适的抗原表位间距下,尽可能避免抗体空间位阻,这时夹心免疫检测比竞争免疫检测具有更高的灵敏度和更宽的检测范围,更适合用于小分子的测定。
2.1小分子夹心与竞争免疫检测的初步比较
2.1.1目标分析物
研究团队首先选择了两个典型的半抗原表位三聚氰胺(MEL)和对硝基苯胺(NIA),并用不同长度的线性链连接子(1-14个亚甲基)来模拟表位距离,创建了9个模型分析物,并将其命名为MN1-MN9。此外,为了评估这两种免疫分析格式的特异性,在MN3的NIA端添加了一个甲基,合成了一种新的结构类似物。模型分析物及用于产生检测抗体的半抗原化学结构见图1。
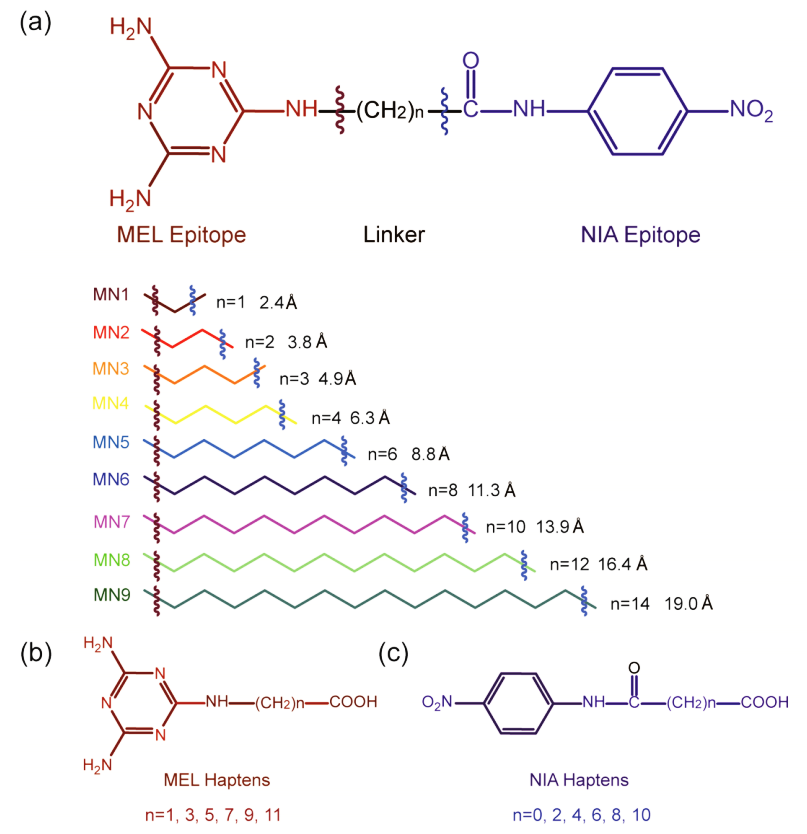
图1.模型分析物和半抗原的化学结构
注:(a)表位距离从2.4到19.0Å(a图下部分)不同的MEL和NIA(a图上部分)组成的9种模型分析物示意图。(b)不同间隔臂长度的MEL半抗原的化学结构。半抗原M1(n=1),半抗原M2(n=3),半抗原M3(n=5),半抗原M4(n=7),半抗原M5(n=9),半抗原M6(n=11)。(c)不同间隔臂长度的NIA半抗原的化学结构。半抗原N1(n=0),半抗原N2(n=2),半抗原N3(n=4),半抗原N4(n=6),半抗原N5(n=8),半抗原N6(n=10)。
表2.模型分析物分子量和表位距离
| 模型分析物 | 分子量(Da) | 表位距离(Å) |
|---|---|---|
| MN1 | 304 | 2.4 |
| MN2 | 318 | 3.8 |
| MN3 | 332 | 4.9 |
| MN4 | 346 | 6.3 |
| MN5 | 374 | 8.8 |
| MN6 | 402 | 11.3 |
| MN7 | 430 | 13.9 |
| MN8 | 458 | 16.4 |
| MN9 | 486 | 19.0 |
2.1.2夹心和竞争免疫检测的比较
研究团队选择了半抗原MEL(M4)的单克隆抗体7A3和半抗原NIA(N4)的单克隆抗体17B3,对模型分析物MN1-MN9及MN3类似物进行夹心和竞争免疫检测。比较了夹心免疫检测和竞争免疫检测的LOD、检测范围和特异性。在合适的表位距离下(11.6-19.0Å),小分子夹心免疫检测具有更高的灵敏度和检测范围。MN6-MN9夹心免疫检测的LOD非常低(0.00035-0.9nM),检测范围比竞争法(LOD为0.001-38.8nM)更宽。MN3类似物的竞争免疫检测灵敏度与MN3相当,而夹心免疫检测并不识别MN3类似物,表明夹心免疫检测对目标分析物具有高特异性。
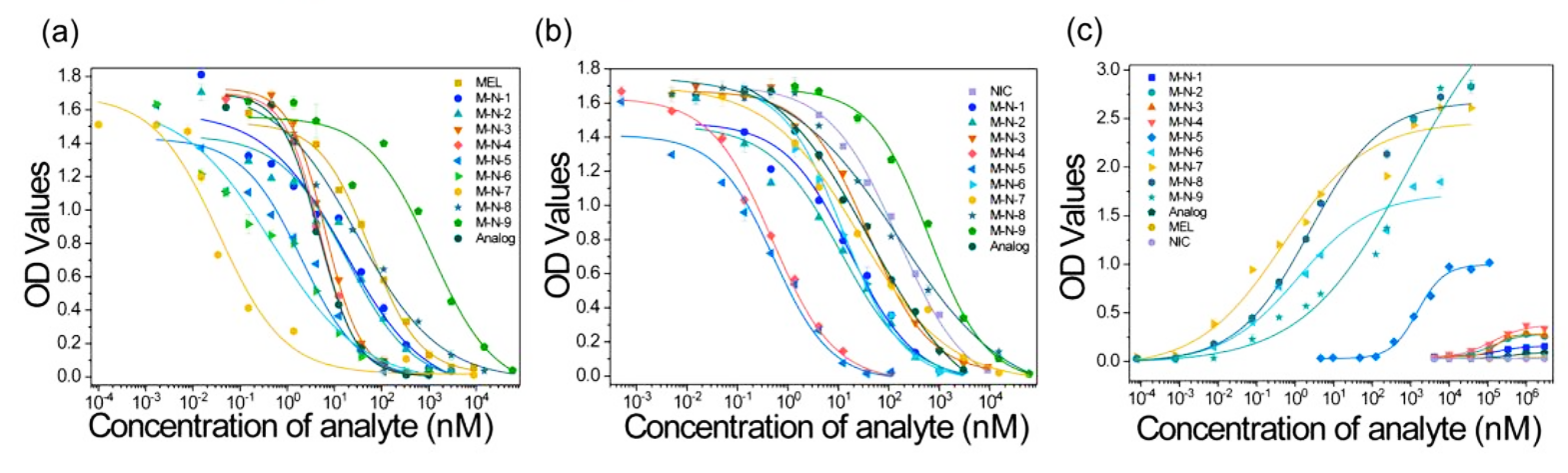
图2.模型分析物夹心和竞争免疫检测的校准曲线
注:(a)基于单克隆抗体(mAb)7A3的竞争免疫检测对MEL、MN1-MN9和类似物的校准曲线(n=3)。(b)基于mAb 17B3的竞争免疫检测对NIA、MN1-MN9和类似物的校准曲线(n=3)。(c)以mAb 7A3为捕获抗体、mAb 17B3为检测抗体对MN1-MN9、MEL、NIA和类似物的夹心免疫检测的校准曲线(n=3)。
表3.MN模型分析物夹心与竞争免疫检测的检测限和线性范围
| 模型分析物 | 检测限(nM) | 检测范围(nM) | ||||
|---|---|---|---|---|---|---|
| 7A3+17B3 | 7A3 | 17B3 | 7A3+17B3 | 7A3 | 17B3 | |
| MN1 | 29944 | 0.2 | 0.6 | 57425-532076 | 10.3-304.2 | 2.1-133.3 |
| MN2 | 21402 | 0.5 | 0.5 | 41759-410439 | 2.7-174.2 | 1.2-106.9 |
| MN3 | 19202 | 0.9 | 0.17 | 38546-392930 | 1.9-21.8 | 5.3-270.5 |
| MN4 | 15335 | 0.7 | 0.02 | 34444-547784 | 1.5-16.5 | 0.07-3.5 |
| MN5 | 265.4 | 0.08 | 0.03 | 504.1-4516.8 | 0.3-14.6 | 0.09-3.1 |
| MN6 | 0.002 | 0.004 | 0.6 | 0.019-123.5 | 0.02-10.1 | 1.8-84.3 |
| MN7 | 0.00035 | 0.001 | 0.7 | 0.0034-220.3 | 0.004-0.33 | 1.5-428.0 |
| MN8 | 0.0094 | 0.4 | 1.7 | 0.078-106.7 | 1.9-47.8 | 5.0-4686 |
| MN9 | 0.9 | 38.8 | 33.7 | 16.2-35399 | 134-9535 | 98.1-3805 |
| 类似物 | / | 0.6 | 0.3 | / | 1.3-16.9 | 1.8-896.1 |
注:夹心和竞争免疫检测的检出限(LOD)定义为使ODmax(IC10)降低10%的分析物浓度。在IC20和IC80之间建立检测范围。/代表阴性结果。
2.2小分子夹心免疫检测优势的进一步验证
为了验证“合适的抗原表位间距下,夹心免疫检测比竞争免疫检测具有更高的灵敏度和更宽的检测范围。”这一结论。研究团队构建了一组新的模型分析物,进一步比较了夹心免疫检测和竞争免疫检测的LOD、检测范围和特异性,结果与初步研究结果一致。
2.2.1目标分析物
使用广泛用于人类和兽医诊所的典型抗菌剂磺胺苄胺(SBA)和诺氟沙星(NOR),合成了两种新的模型分析物SBA-C2-NOR和SBA-C10-NOR。
表4.模型分析物分子量和表位距离
| 模型分析物 | 分子量(Da) | 表位距离(Å) |
|---|---|---|
| SBA−C2−NOR | 679 | 3.8 |
| SBA−C10−NOR | 791 | 13.9 |
2.2.2夹心免疫检测的优势验证
用半抗原SBA的单克隆抗体4D11和半抗原NOR的单克隆抗体N2H3A8,对模型分析物SBA−C2−NOR和SBA-C10-NOR进行测定。结果显示,与竞争免疫检测相比,夹心免疫检测对SBA-C10-NOR(抗原表位距离为13.9Å)的敏感性、检测范围和特异性方面,具有明显的优势,其中LOD较竞争法提高了近30倍。
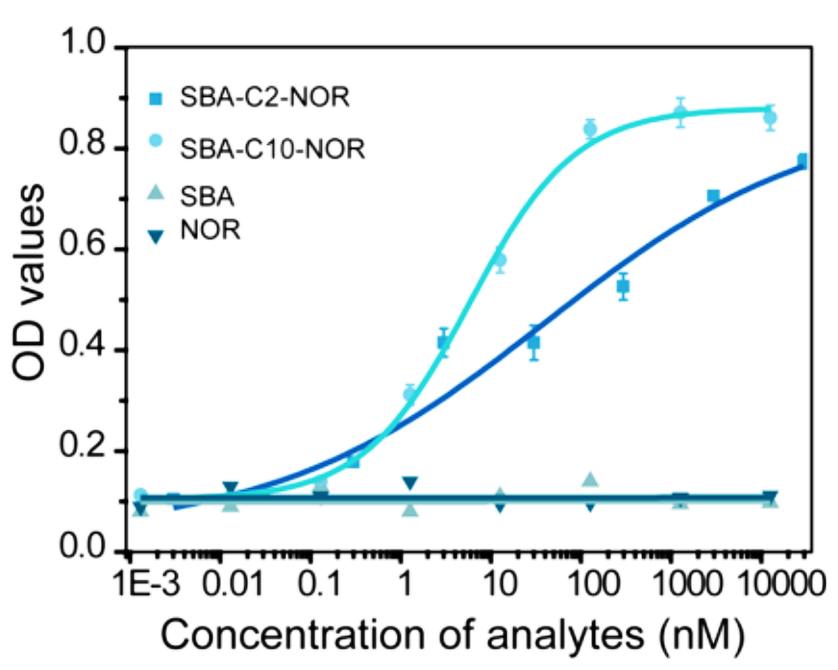
图3.模型分析物夹心和竞争免疫检测的校准曲线
表5.模型分析物夹心与竞争免疫检测的检测限和线性范围
| 模型分析物 | 检测限(nM) | 检测范围(nM) | ||||
|---|---|---|---|---|---|---|
| 4D11+N2H3A8a | 4D11b | N2H3A8c | 4D11+N2H3A8a | 4D11b | N2H3A8c | |
| SBA−C2−NOR | 0.3 | 0.53 | 0.13 | 0.89-37.43 | 1.18-18.64 | 0.30-4.80 |
| SBA−C10−NOR | 0.02 | 0.61 | 0.21 | 0.33-48.22 | 1.38-22.58 | 0.47-7.30 |
a.基于4D11和N2H3A8抗体的夹心免疫检测结果。
b.基于4D11抗体的竞争免疫检测结果。
c.基于N2H3A8抗体的竞争免疫检测结果。
夹心免疫检测在小分子检测中的主导作用,很大程度上取决于目标分析物的结构和最佳抗体对。两个抗体识别分析物的表位距离适当时,会避免抗体空间位阻,此时夹心法比竞争法免疫检测具有更高的灵敏度和更宽的检测范围,更适合用于小分子测定。
参考文献
[1] 免疫检测原理与应用[M].北京: 人民卫生出版社, 2021: 6-7.
[2] Grassi J, Créminon C, Frobert Y, et al. Two different approaches for developing immunometric assays of haptens[J]. Clin Chem. 1996, 42(9): 1532-6.
[3] Bai Y, Fei J, Wu W,et al. Minimum Distance Between Two Epitopes in Sandwich Immunoassays for Small Molecules[J]. Anal Chem,2022, 94(51): 17843-17852.
注:文章引用或转载的内容仅供交流和学习使用。

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302