新冠病毒突变株B.1.1.7简介
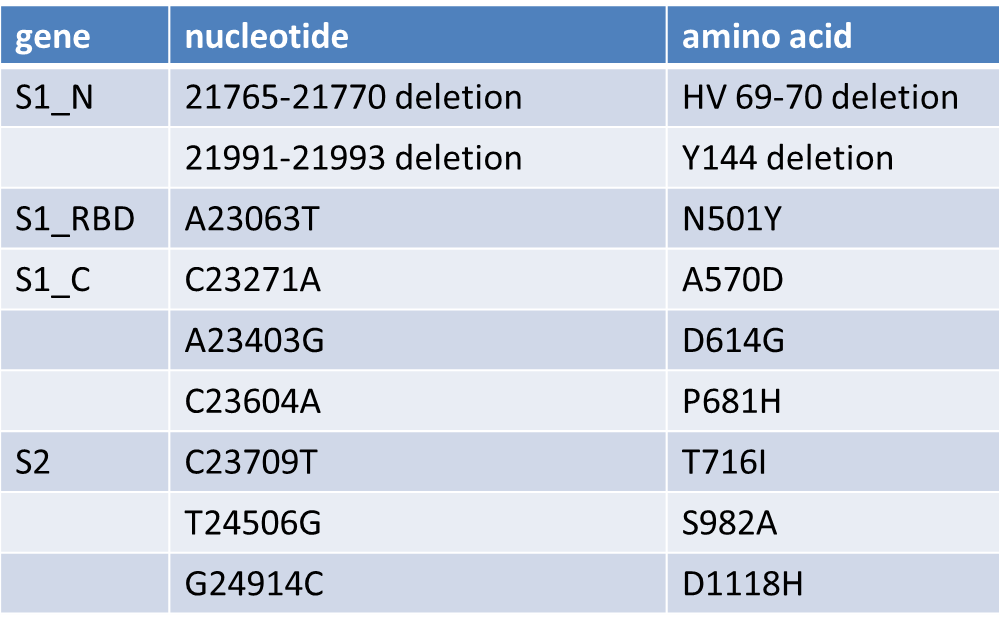
B.1.1.7突变毒株,又称20I/501Y.V1或VOC 202012/01,2020年12月在英国最早被发现,随后在美国、加拿大、日本等多个国家都报道了B.1.1.7谱系的病例。B.1.1.7突变毒株与人ACE2受体结合亲和力提高了1000倍, 传染能力是原始毒株的1.7倍。B.1.1.7谱系在D614G突变的基础上一次性获得了17个突变位点,S蛋白上包含9个突变位点:
1)位于S1 N末端结构域(NTD)的69-70, Y144位氨基酸缺失;
2)位于受体结合域(RBD)上的N501Y突变;
3)位于S1 C末端结构域的A570D, D614G, P681H;
4)位于S2上的T716I, S982A, D1118H。
关键突变位点对SARS-CoV-2功能的影响
1.69-70del
该突变表现为新冠N端结构域(NTD)中H69和V70缺失,单一的H69/V70缺失并不常见,其常常伴随着RBD突变。除了B.1.1.7病毒株(N501Y+69-70del)外、丹麦水貂突变毒株(N439K+Y453F+69-70del)也呈现这种趋势。H69/V70缺失会使周围I68、S71、G72、T73、N74和G75向内移动形成突起环,并靠近NTD的结合表位。已有研究表明NTD中的H69/V70缺失可以逃避NTD特异结合中和抗体的途径,有利于病毒逃离宿主的免疫反应,但目前尚未明确免疫逃逸是由H69/V70缺失导致的NTD构象引起的。
2.D614G突变
D614G突变具有更强的感染性,目前是新冠突变毒株的主要形式。D614G突变会增加S1/S2交界处Furin蛋白酶切割效率。当D突变为G时,D614残基与相邻原聚体S2区域上T859残基形成的氢键消失,提升了Furin蛋白酶切割效率,使得S1蛋白更易从S2蛋白-病毒膜融合体上脱落,促进病毒膜融合进程,暗示D614G突变对宿主细胞具有更强或更快的感染力。同时,D614G还会改变RBD蛋白的构象去更好地与ACE2配位。D614毒株中,53%RBD聚体为全封闭,47%为单开放,40%的RBD处于“向上”状态;G614毒株中,5%为全封闭,36%为单开放,39%为双开放,20%为三开放,82%的RBD处于“向上”状态。这种更高的RBD状态“向上”的倾向以及更加开放的RBD聚体结构使得D614G突变更易与ACE2结合。
3.N501Y
N501位氨基酸是新冠病毒RBD蛋白的关键接触残基之一,直接参与RBD和ACE2的结合作用,而N501Y突变增强了RBD和ACE2的结合亲和力。N501属于亲水性残基,病毒结合ACE2时,N501靠近ACE2的Y41疏水苯环和K353疏水烷烃链;但当N501突变为疏水残基Y时,Y501则可以通过疏水作用与ACE2中的Y41和K353更好的配位,改善RBD和ACE2互作构象,将结合亲和力提高约0.81kcal/mol,同时使原来不感染小鼠的新冠病毒毒株获得感染能力。N501Y突变对于靶向RBD中和表位的中和抗体的结合效力影响较小。研究发现,N501毒株与中和抗体结合VH-Fc ab8后(该分子融合表达了可变重链区域VH和人类IgG1的Fc片段),S蛋白呈现两种构象即两个RBD分子处于“向上”位置和仅有一个RBD分子处于“向上”位置。N501Y突变毒株的S蛋白则表现为单一构象:两个RBD分子处于“向上”位置。每个RBD分子都会绑定到VH-Fc ab8上,突变的存在不会改变RBD与中和抗体的相互作用,不存在免疫逃逸现象。
B.1.1.7突变毒株表现为与ACE2亲和力增强、病毒传染能力增强,但是研究发现mRNA新冠疫苗BNT162b2接种者血清对于B.1.1.7毒株S蛋白中和活性影响不大,推测B.1.1.7突变毒株不会影响现有的疫苗及中和抗体研究。而南非突变株对中和效应可能会带来削弱影响。
参考文献
[1] Estimated transmissibility and severity of novel SARS-CoV-2 Variant of Concern 202012/01 in England.
[2] Recurrent emergence and transmission of a SARS-CoV-2 Spike deletion H69/V70.
[3] Natural deletions in the SARS-CoV-2 spike glycoprotein drive antibody escape.
[4] Yurkovetskiy L , Wang X , Pascal K E , et al. Structural and Functional Analysis of the D614G SARS-CoV-2 Spike Protein Variant[J]. SSRN Electronic Journal, 2020.
[5] D614G Spike Mutation Increases SARS CoV-2 Susceptibility to Neutralization.
[6] Rapid adaptation of SARS-CoV-2 in BALB/c mice: Novel mouse model for vaccine efficacy.
[7] The New SARS-CoV-2 Strain Shows a Stronger Binding Affinity to ACE2 Due to N501Y Mutation.
[8] Molecular Mechanism of the N501Y Mutation for Enhanced Binding between SARS-CoV-2's Spike Protein and Human ACE2 Receptor.
[9] Cryo-EM Structure of the N501Y SARS-CoV-2 Spike Protein in Complex with a Potent Neutralizing Antibody.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302