猴痘病毒(MPXV)与天花病毒基因组比对
天花是由痘病毒科正痘病毒属成员天花病毒(VAR)引起的一种死亡率高的人类流行性疾病。由于真空吸虫病病毒(VAC)衍生的一种高度安全和廉价的疫苗的诞生,大规模接种疫苗以及彻底的流行病学监测,使天花于1977年在全球被根除。在根除天花之后,世界各地终止了疫苗接种。这为人畜共患正痘病毒如:猴痘病毒(MPV)、牛痘(CPV)和布氏痘等传播和适应性突变提供了机会。猴痘病毒(MPV)是最受关注的人畜共患正痘病毒。猴痘和天花的临床相似性,引发了关于病毒的遗传关系以及MPV是否会进化成一种具有高频率人传人VAR样病毒的猜想。
猴痘病毒与天花病毒的基因组差异
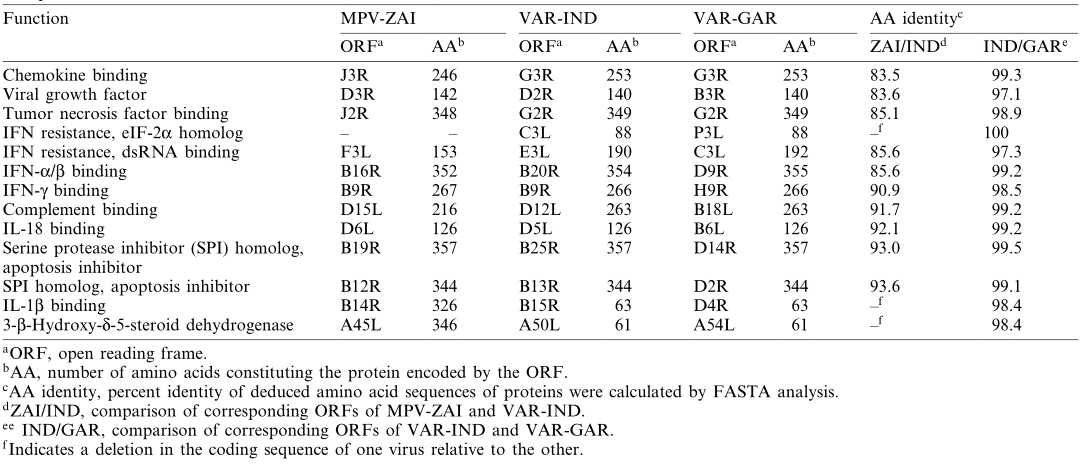
俄罗斯国家病毒学和生物技术“载体”研究中心的Sergei N. Shchelkunov等科学家对1996年在扎伊尔一次大规模猴痘暴发期间从患者身上分离的MPV进行了197 kb基因组测序。通过将MPV的基因组序列与引起严重疾病的印度1967株(VAR- IND)和引起相对轻微疾病的小天花Garcia-1966株(VAR- GAR)的基因组序列进行了比对,发现MPV基因组中部编码必需酶和结构蛋白的核苷酸序列与天花病毒(VAR)的同源性为96.3%。而基因组末端编码毒力和宿主范围因子的区域有相当大的差异。MPV中两个干扰素(IFN)抗性基因的突变以及白细胞介素- 1β(IL-1β)抑制的存在可能导致这两种病毒特性差异,也可能限制了猴痘作为天花模型的用途。虽然广泛的基因差异证实了MPV不是VAR的直系“亲属”,但不排除未来MPV对人类的适应性。
1. 基因全长
MPV-ZAI基因全长196858 bp,包含≥60个氨基酸残基190个基本不重叠的ORF,其结构特征和GC含量(31.1%)与其他正痘病毒相似。MPV-ZAI基因的编码序列全长比VAR长,为195118 bp。MPV DNA较长的长度主要是由于左侧4个末端ORF的重复,作为末端反向重复(TIR)的一部分,而VAR基因组是非常短的无基因TIR,缺乏ORF重复(图1)。
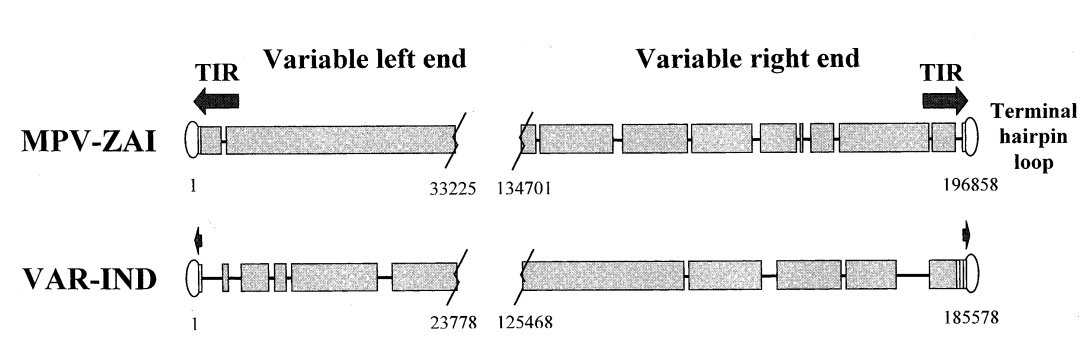
图1. MPV-ZAI和VAR-IND末端物种特异性可变基因组区域示意图
注释:TIR用箭头表示,短串联末端重复区域用矩形表示。重合序列用宽黑色块表示;一个基因组相对于其他基因组的缺失显示为线。可变基因组区域的边界由与其在基因组中的位置相对应的核苷酸数标记。
2. 中心基因组
正痘病毒的中心基因组区主要包含高度保守的必需基因。MPV-ZAI DNA的中心基因组区共有101 466 bp,由C10L和A25R ORF划定,与VAR-IND的同源性为96.3%。MPV-ZAI这一区域编码的病毒体蛋白氨基酸序列与VAR-IND有91.7-99.2%的相似性。
3. 末端区域
1)毒力因子
值得注意的是,MPV-ZAI突变是两个IFN抗性基因的翻译,它们在VAR和其他正痘病毒中是完整的胞内蛋白。其中一个(VAR-IND中的C3L,表1)是真核翻译起始因子2α(eIF-2α)的同源物,通过充当诱饵抑制双链RNA依赖蛋白激酶(PKR)的抗病毒活性。MPV(株ZAI和CNG)基因组不编码这种蛋白质。研究表明,缺乏该基因的突变VAC表现出IFN敏感性,与亲本病毒相比,病毒产量降低了约100倍。另一个IFN抗性基因(VAR-IND中的E3L,表1),存在于VAR和其他正痘病毒中,分别由第1或第2蛋氨酸以长或短的形式表达(图2A)。在VAC中,该基因编码的长形蛋白N端结构域介导与Z-DNA的结合、核定位和PKR相互作用,是VAC毒性必需的蛋白。短型或长型蛋白的C端结构域可结合双链RNA,抑制IFN诱导的PKR和2-5A合成酶的激活,是IFN抗性和VAC宿主范围所必需的。MPV的第一个翻译起始密码子和下游的无义突变明显,因此只有短形式的翻译(图2A)。这两种IFN的突变,可能导致MPV比VAR更少的人际传播。
MPV编码一种互补结合蛋白,只有3个短重复,而在其他正痘病毒中有4个(图2B)。另外,MPV编码分泌的IL-1β结合蛋白和3-l-羟基-δ-5甾体脱氢酶,在VAR菌株没有完整的ORF(表1)。值得注意的是,编码IL-1β结合蛋白的VAC基因与发热和致病性相关。因此,MPV中IL-1β结合蛋白的存在可能是其致病性低于VAR的原因之一。
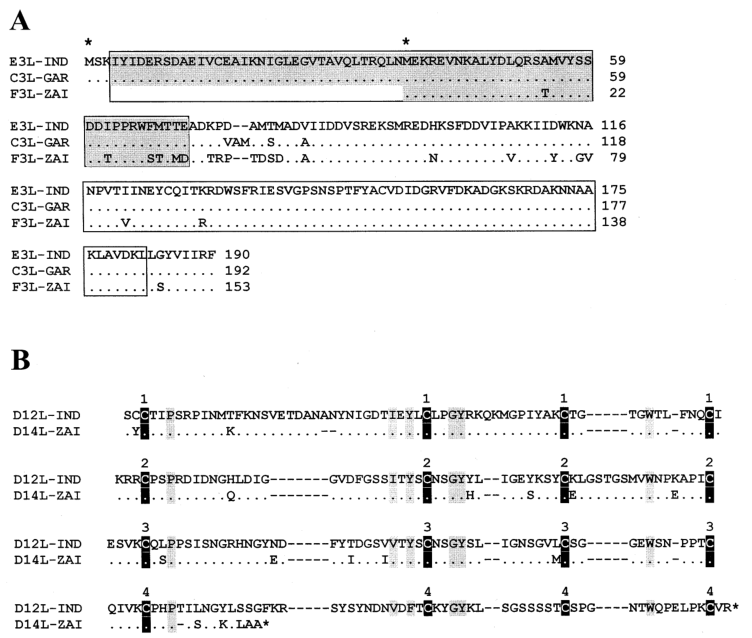
图2. MPV与VAR IFN抗性因子及互补结合蛋白氨基酸序列比对
注释:图2A是对VAR-IND、VAR-GAR、MPV-ZAI对应基因编码的正痘病毒E3L IFN抗性因子氨基酸序列进行比对。显示含有N端腺苷脱氨酶Z-α结构域(灰色标记)和C端双链RNA结合基序的区域。相同的氨基酸残基用圆点标记;氨基酸缺失用破折号标记。第一个和第二个蛋氨酸残基开始一个长或短形式的蛋白质用星号标记在序列上方。图2B是正痘病毒互补结合蛋白的氨基酸序列比对。显示VAR-IND和MPV-ZAI的ORF。保守的半胱氨酸残基用黑色垂直块标记,其他保守残基用灰色垂直块标记。方块上面的数字表示互补控制蛋白的四个典型重复区域。
表1. MPV与VAR毒力因子比对
2)锚蛋白子
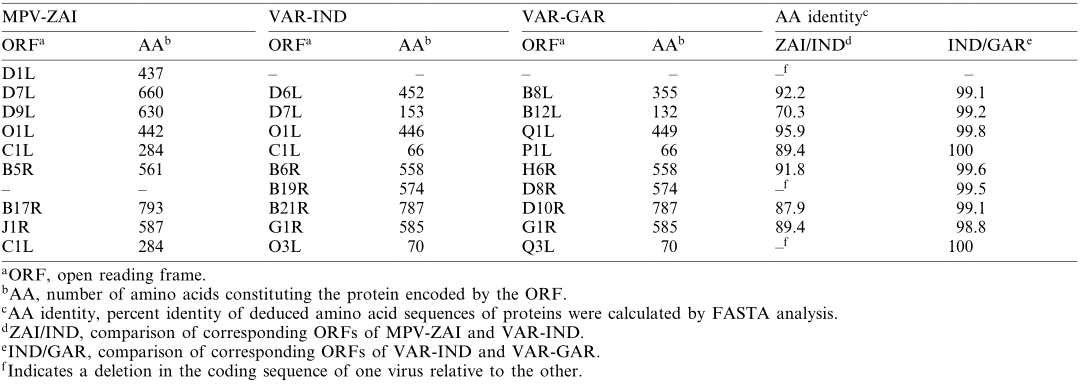
含有锚蛋白重复序列的编码蛋白ORF,其中一些具有宿主范围功能(正痘病毒同源的MPV-ZAI D7L和C1L),是最大的正痘病毒基因家族。在属于这个家族的10个基因中,MPV-ZAI基因组中与VAR-IND B19R对应的基因被删除,MPV-ZAI基因D1L对应的基因在两个VAR株中均缺失。此外,该家族的4个VAR基因(VAR-IND中的D6L、D7L、C1L和O3L)相对于MPV同源基因被截断。目前,我们只能推测这些差异可能如何影响宿主范围或毒性。
表2. MPV与VAR锚蛋白比对
4. 系统发育树分析
为了更好地理解遗传关系,利用117600 bp的DNA对4种人类致病性正痘病毒的末端可变基因组区域进行了系统发育分析(图3)。VAR的主要亚种和次要亚种关系密切,MPV与VAR的距离比VAC略远。
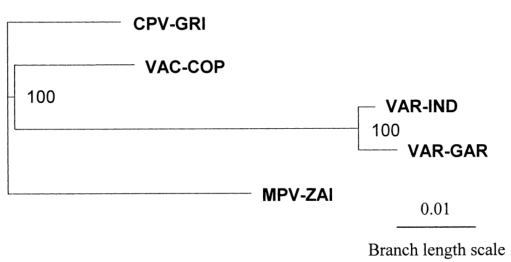
图3. MPV、VAR、CPV、VAC末端可变基因组序列系统发育树分析
综上所述,MPV和VAR基因组比对结果表明,MPV毒力基因与VAR的主要株和次要株存在多重差异。MPV和VAR很可能是独立于正痘病毒祖先进化而来的。VAR和MPV之间的遗传差异对该MPV天花模型的有效性提出了相当大的疑问。然而,MPV本身引起的严重疾病,我们需要密切监测MPV感染率,以确保它不会在艾滋病高发的未接种疫苗人群中通过自发或重组的方式进行人类适应。
参考文献
Sergei N. Shchelkunova, Alexei V. Totmenina, Igor V. Babkin, et al. Human monkeypox and smallpox viruses: genomic comparison[J].FEBS Letters,2001,509:66-70.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302