痘病毒的形态结构、传播方式及复制周期
自从1980年在世界范围内根除天花以来,人们几乎不再开发天花病毒的疗法。2022年世界范围内的猴痘爆发让天花重回公众视野,人们担心天花病毒或与它同属的猴痘病毒可能成为恐怖主义潜在的生物武器。天花病毒(Variola virus)、猴痘病毒(Monkeypox virus,MPXV)同属于痘病毒科-脊索痘病毒亚科-正痘病毒属。痘病毒是已知最大的动物病毒,可感染大多数脊椎和无脊椎动物。痘病毒是一种双链DNA病毒,具有约200个不同的基因,基因产物的一个子集可独立于宿主细胞核执行病毒所必需的功能,其他基因产物可广泛使用、调节宿主细胞和免疫系统。
人类流行病史上较为有名的正痘病毒包括天花病毒(Variola virus)、痘苗病毒(Vaccinia virus,VACV)、牛痘病毒(Cowpox virus,CPXV)及猴痘病毒(Monkeypox virus,MPXV)。天花(Variola virus)是引起人类天花的病原体,在美国发现了两种临床流行病学变种:大天花病毒(Variola major virus)和小天花病毒(Variola minor virus或alastrim virus),其致死率分别是5-40%和1%,从致死率来看大天花病毒的毒性更强。牛痘病毒(Cowpox virus,CPXV)因其与奶牛乳头和挤奶工人手上的脓疱病变有关而得名。有趣的是,在自然界中牛并不是CPXV的天然宿主,其引发的牛痘也不是一种常见疾病。痘苗病毒(Vaccinia virus,VACV)是实验室广泛使用的痘病毒模型,曾被用于制备天花疫苗,其中M-63(苏联)、Lister(英国)、天坛(中国)以及Wyeth、IHD(美国)VACV毒株使用最广泛。
痘病毒基因组
痘病毒基因组是线性双链DNA,两端具有长度可变的反向串联重复序列,形成发夹结构。从痘苗病毒Copenhagen和WR病毒株完整的测序信息来看,痘苗病毒基因组全长191kbp,12kbp的反向末端重复序列(ITR)末端为共价连接的单链发夹环,序列富含AT,包含短的直接重复序列和多个ORF。痘病毒可完全在细胞质中进行复制,对宿主细胞的DNA和RNA依赖程度低。病毒可通过产生和分解大的串联分子合成新的基因,新基因包装不严格,为基因组扩增提供了有利条件,在此过程中病毒获得新的功能完成进化。
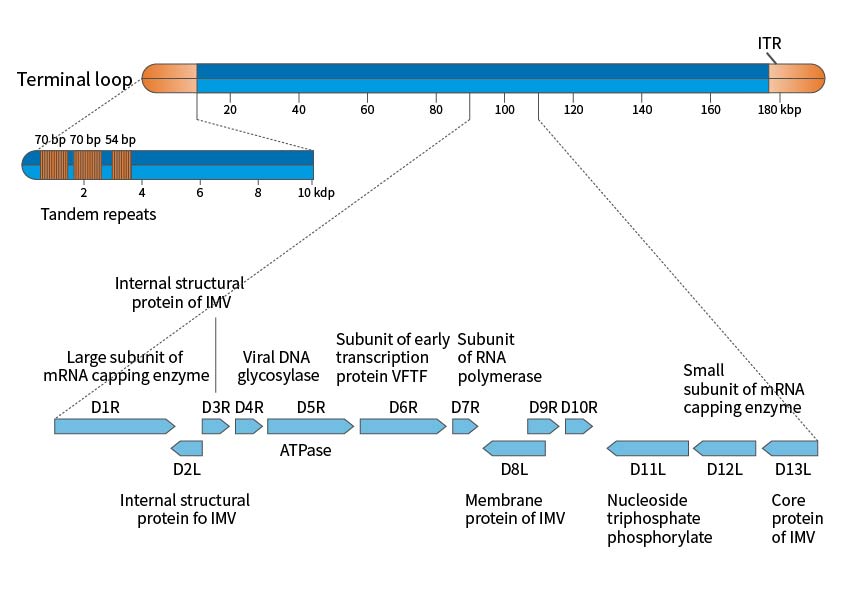
图1. 痘苗病毒基因组示意图
痘病毒形态结构
痘病毒科是迄今所知结构最复杂的一类病毒,痘病毒粒子呈椭圆形或砖状结构,长度约为200-400nm,轴比为1.2-1.7。膜是典型的50-55nm脂蛋白双分子层,包裹在核心周围,外表面布满随机排列的小管元件(STE),平均宽7nm,长100nm。病毒粒子由核和被膜包围的相关侧体组成,具有足够的传染性;然而,对于某些病毒株和某些细胞的感染,病毒粒子会获得一个额外的脂质双分子层,它具有自己独特的化学成分,称为包膜(Envelope)。这种包膜所含的磷脂大约是未包膜病毒粒子的两倍。大量研究显示,病毒包膜上的抗原能够引起免疫,保护宿主抵御痘病毒的攻击。痘病毒包膜至少含有7种不同的糖蛋白,以及一种主要的非糖基化酰化多肽。
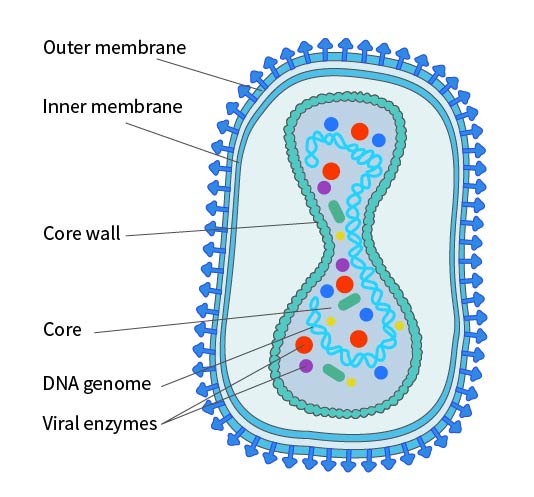
图2. IMV形式的痘病毒结构示意图
注:是否存在内膜尚有争议。
痘病毒传播方式
病毒的传播过程根据痘病毒种类及宿主的不同差别较大,通常包括以下几种方式:1)在细胞质中保持游离态;2)迁移到细胞表面并通过微绒毛排出;3)被来自高尔基体的两层膜包裹,运输到细胞表面,然后被包膜(来自高尔基体内池膜)释放;4)通过出芽形成大液泡获得包膜;5)它们与无膜的液泡结合;6)它们以一种嗜酸的细胞质结构的形式与一种蛋白质物质相结合,这种结构被称为a型包涵体(ATI)。
痘苗病毒复制周期
痘病毒复制周期因病毒种类而异,以模型病毒——VACV为例,复制一般发生在感染后2-5h。病毒成熟需经历五个阶段:未成熟病毒体(IV)、细胞内成熟病毒体(IMV)、细胞内包膜病毒体(IEV)、细胞相关包膜病毒体(CEV) 和细胞外包膜病毒体(EEV)。IMV和EEV是痘苗病毒的主要传染形式,EEV比IMV更具传染力,可通过非pH依赖方式与质膜融合,进入细胞。EEV负责胞间传输,最终会作为IMV从细胞释放到外部环境中,与EEV相比IMV更稳定,负责宿主间传输。
脱壳
病毒和细胞膜融合后,发生初级脱壳,病毒核心被释放到细胞质中。核心除了有病毒基因组,还有依赖于病毒DNA的RNA聚合酶、特异性识别病毒早期基因启动子所需的“起始”蛋白质,以及几种修改病毒转录本的RNA处理酶。核心释放后合成病毒早期mRNA(图3,步骤2),这些mRNA表现出细胞mRNA的典型特征,被细胞识别翻译(图3,步骤3)。大约一半的病毒基因在感染早期表达。一些与细胞生长因子具有序列相似性的早期蛋白从细胞中分泌(图3,步骤4),诱导邻近宿主细胞增殖或抗宿主免疫防御机制。早期蛋白质的合成诱导第二次脱壳,核心壁打开,含基因组的核蛋白复合体从核心释放(图3,步骤5),病毒早期基因表达停止。
复制
早期蛋白催化病毒DNA基因组复制(图3,步骤6),新合成的病毒DNA分子作为下个复制周期的模板(图3,步骤7),它们也是病毒中间期基因的转录模板(图3,步骤8)。中间基因转录激活需要特定的病毒蛋白(早期基因的产物),赋予病毒RNA聚合酶上的中间启动子特异性,以及从受感染细胞核重新定位到细胞质的宿主细胞蛋白(Vitf2)。中间mRNA编码的蛋白质(图3,步骤9),包含晚期基因转录所需的蛋白(图3,步骤10)。末期基因编码构建病毒粒子的蛋白质、病毒粒子的酶和其他组装过程所需的早期起始蛋白。这些病毒蛋白借助细胞翻译机制合成(图3,步骤11)。
组装
病毒膜蛋白是无糖基化的,细胞膜在组装早期的作用存在争议(图3,步骤12)。最初的组装形成未成熟病毒粒子(图3,步骤13),它是一种由膜分隔的球形粒子,可从细胞分泌途径的早期获得。该病毒颗粒成熟后形成砖状IMV(图3,步骤14),在细胞裂解时释放(图3,步骤15)。此外,颗粒可以从跨高尔基体或早期内小体室获得第二层双层膜,形成胞内包膜病毒粒子(IEV)(图3,步骤16)。
分离
IEV移动到细胞表面的微管上,与质膜融合形成细胞相关病毒粒子(CEV)(图3,步骤17)。这些CEV诱导肌动蛋白聚合,促进肌动蛋白直接转移到周围细胞(图3,步骤18);它们也可以从膜上分离出来,形成EEV。
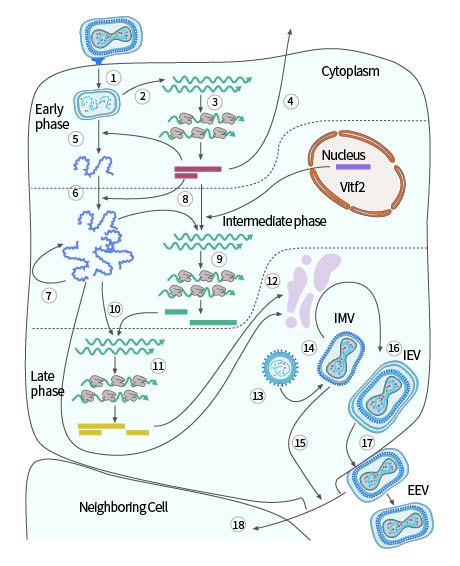
图3. 痘苗病毒的单细胞繁殖周期
参考文献
[1] Buller RM, Palumbo GJ. Poxvirus pathogenesis[J]. Microbiol Rev., 1991,55(1): 80-122.
[2] Harrison SC, Alberts B, Ehrenfeld E,et al. Discovery of antivirals against smallpox[J]. Proc Natl Acad Sci U S A., 2004, 101(31): 11178-11192.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302