Tau蛋白的分类、结构及生物学功能
Tau蛋白是20世纪70年代中期通过研究微管形成所需的因素而发现的一种低分子量微管相关蛋白(microtubule associated protein,MAP),主要分布在中枢神经系统,多数存在于神经元的轴突中,少数存在于少突胶质细胞中。Tau蛋白诱导与促进微管蛋白聚合成微管,并与新聚合的微管束缚在一起,防止解聚,维持其结构的稳定性,保持微管间的距离,影响神经元轴突的蛋白激酶的附着点,且在神经元可塑性中起着重要的作用。Tau蛋白还可通过维持微管系统的稳定,为轴突生长延伸创造条件,进而提高神经突触的生长速率和范围。此外,Tau蛋白在促进少突胶质细胞成熟中具有重要作用。当Tau蛋白发生高度磷酸化、异常糖基化、异常糖化以及泛素蛋白化时,Tau蛋白失去对微管的稳定作用,神经纤维退化、功能丧失。
1. 基因表达与分类
Tau由17号染色体上的MAPT基因编码,基因长度>100kb,包含16个外显子。外显子1是启动子的一部分,被转录但不被翻译。外显子1、4、5、7、9、11、12和13是组成型外显子。外显子2、3和10交替剪接,外显子2可以单独出现,但外显子3不可独立于外显子2出现。在中枢神经系统中,外显子2、3和10选择性剪接产生6种Tau异构体:0N3R、1N3R、2N3R、0N4R、1N4R和2N4R Tau。根据易溶性及磷酸化程度Tau可分为:易溶型非异常磷酸化的Tau(C-Tau)、易溶型异常磷酸化的Tau(ADp-Tau)、不溶性以双螺旋丝聚集的Tau(PHF-Tau)。C-Tau生物学活性类似于正常Tau蛋白;ADP-Tau没有生物学活性,但未聚合成PHF;PHF-Tau是从神经元纤维缠结中提取的异常过磷酸化的Tau蛋白。
2. Tau蛋白结构
Tau蛋白二级结构(如α-螺旋或β-片层结构)含量低,是一种典型的“天然展开”蛋白质,具有耐热性,且不易受酸处理影响。Tau蛋白由N端结构域、富含脯氨酸的结构域、微管结合结构域和C端结构域组成。在中枢神经系统中,外显子2、3和10的选择性剪接主要影响N端投射区和微管结合结构域(MBD)。Tau根据微管结合重复序列(microtubule-binding repeat,MTBR)的数量可分为4重复(4R Tau:0N4R、1N4R、2N4R)和3重复(3R Tau:0N3R、1N3R、2N3R)两种。N1和N2由外显子2和3编码,N1或N2可以被跳过,但是N2需与N1同时表达。剪接包含外显子10会表达4R Tau,而不包含外显子10会表达3R Tau。
Tau亚型的大小从352到441个氨基酸残基不等,每一种都具有特定的生理作用,在大脑发育过程中差异表达。3R Tau和4R Tau在成人大脑中保持平衡比例(1:1),其中3R Tau主要在发育过程中产生,4R Tau在成年期产生。4R Tau在促进微管组装方面表现出比3R Tau更强的活性。3R和4R比例的破坏与AD以及其他Tau蛋白病有关,如:进行性核上性麻痹、皮质基底节变性、FTDP-17和嗜银颗粒病中,4R与3R Tau的比例增加,但在皮克氏病中比例下降。AD中没有明确的模式,因为含有Tau缠结的大脑脆弱区域在某些情况下显示4R Tau亚型增加,而在其他情况下显示3R Tau亚型增加。
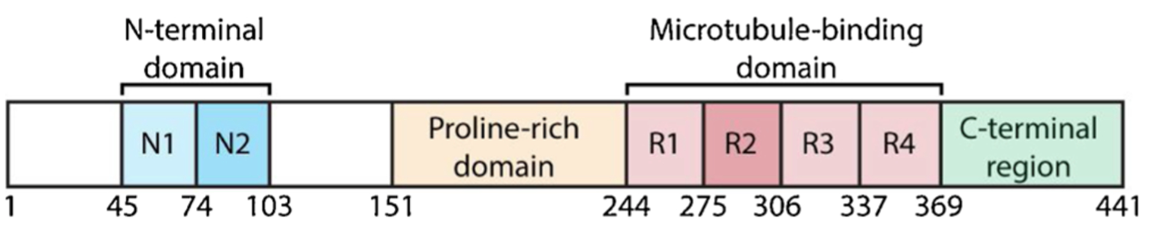
图1. 2N4R Tau的结构域
注:蓝色为Tau蛋白的N端结构域;棕褐色为富含脯氨酸的结构域;粉色为微管结合结构域;绿色为C端结构域。
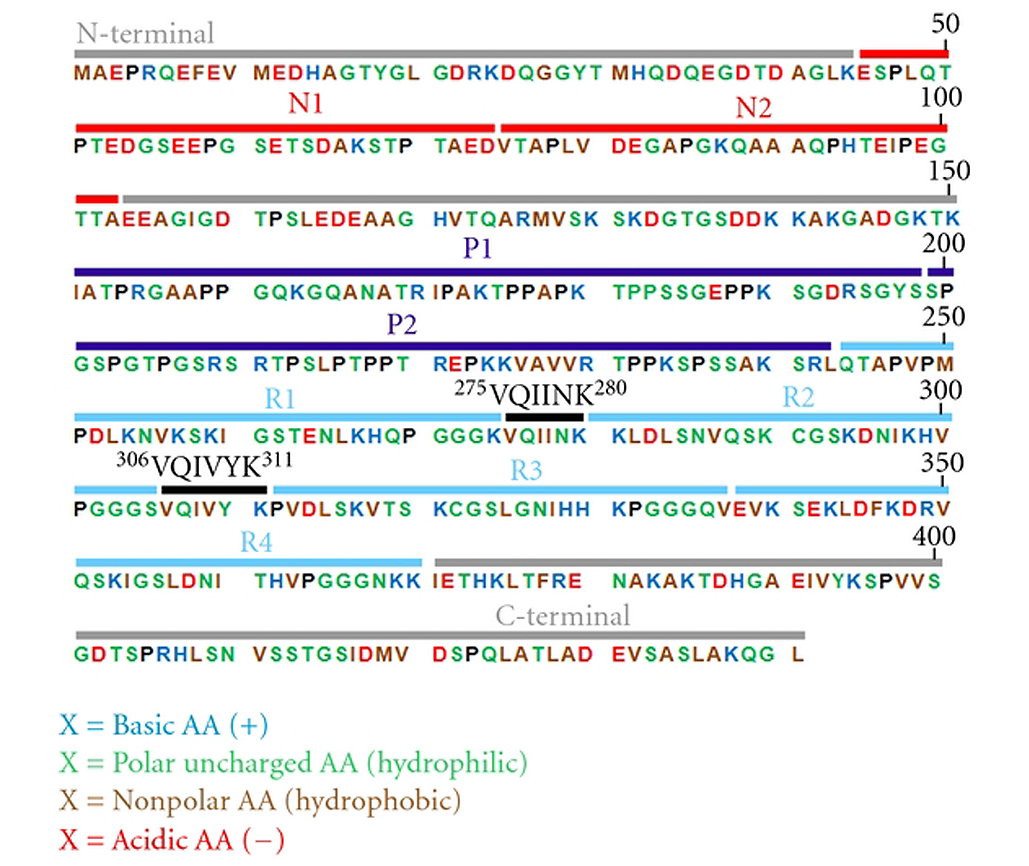
图2. 最长Tau亚型的氨基酸序列(441个氨基酸)
注:现在人类中枢神经系统中发现的最长的Tau亚型含有441个残基。N1和N2是外显子2、3编码的多肽序列;P1和P2为富含脯氨酸的区域;R1–R4为由外显子9–12编码的微管结合域;275VQIINK280和306VQIVYK311是具有β结构的序列。
2.1 微管结合域
体外Tau蛋白可增加微管聚合速率,同时抑制其解聚速率,作为微管蛋白聚合的促进剂,其主要功能取决于MTBR。Tau蛋白质C端具有3~4个含31或32个氨基酸残基的重复区(R1–R4),即主体结构呈Pro-Gly-Gly-Gly的“重复串联”,构成了Tau蛋白的微管结合区。MTBR在胎儿Tau蛋白中重复3次,在成人特定形式中重复4次。每个重复由高度保守的18个残基组成,并通过13或14个残基间隔区彼此分开。诱导微管聚合的最有效部分是R1-R2区域间中的肽275KVQIINKK280,这是4R Tau所独有的。
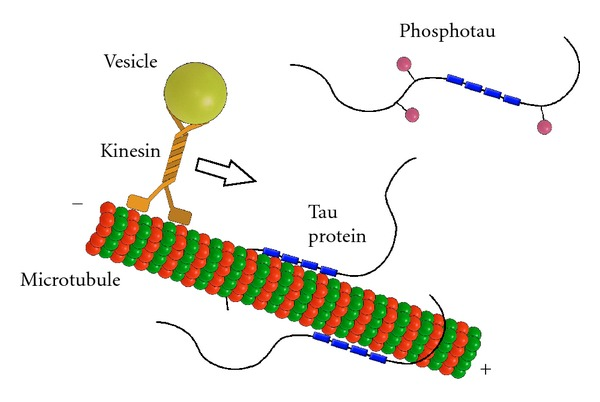
图3. Tau蛋白的正常功能
对于最长的亚型,Tau蛋白通过4个微管蛋白结合域(图3蓝色框)牢固地结合在微管的外表面,促进微管的组装,并参与轴突运输。在细胞中,微管可以通过动态不稳定性改变其长度,是微管依赖性运动蛋白介导的细胞器运输轨道。例如正端定向运动驱动蛋白及其相关物,或负端定向运动动力蛋白可以通过微管分别将线粒体、溶酶体、过氧化物酶体、内吞囊泡或胞外囊泡运送到细胞外围或返回到微管组织中心(MTOC)。Tau蛋白可以影响轴突运输,Tau通过激酶和磷酸酶的协调作用维持磷酸化(图3粉红球)平衡,调节其与微管结合的亲和力,改变微管依赖性的细胞内运输。
2.2 富含脯氨酸的区域
Tau蛋白通过其富含脯氨酸的区域与多种蛋白的Src同源3(SH3)结构域结合,如Fyn(一种来自Src家族的酪氨酸激酶)。Tau可以通过与树突棘中的Fyn相互作用调节N-甲基-D-天冬氨酸(NMDA)受体信号传导。病理性Tau可能参与Fyn激酶在突触后区室的定位,在突触后区室磷酸化NMDAR亚基,导致向内Ca2+电导增加并导致兴奋性毒性。在少突胶质细胞中,Tau与Fyn的结合调节细胞质过程的生长。
2.3 N端结构域
N-末端称为外伸结构域,它从微管表面外伸出来,与其他细胞骨架成分和细胞膜接触,在维持轴突的稳定中发挥重要的作用。Tau蛋白的N端结构域决定了轴突微管之间的间距。外周神经元通常有一个直径很大的长轴突。这种类型的神经元包含一个额外的N端Tau序列,由外显子4A编码,因此会生成一种称为“大Tau”的特定Tau亚型。Tau蛋白投射域可从微管表面投射出来,与其他细胞骨架元件和神经元质膜相互作用。
3. Tau蛋白功能
Tau蛋白作为轴突微管组装的启动子,在维持神经元投射和影响突触功能方面发挥作用。Tau蛋白与微管结合的缺失可能导致突触功能障碍。正常的Tau蛋白主要与轴突中的微管相关,参与突触后区的突触活动。在生理或病理条件下,Tau蛋白被募集到突触后和树突。突触活动驱使Tau蛋白到达突触后致密区,在那里Tau蛋白与突触后密度蛋白相互作用。树突Tau蛋白大多被过度磷酸化,不与微管结合。在阿尔兹海默症(AD)或其他Tau病变中,树突Tau在树突丢失、突触后活动异常和认知功能障碍中发挥重要作用。病理分子机制可能涉及NMDA或AMPA受体的调节,例如,树突Tau通过与Fyn激酶络合来触发NMDA受体磷酸化来介导Aβ依赖性兴奋毒性。
在突触前,致病性Tau可能干扰正常的突触囊泡释放。过度磷酸化的Tau蛋白可以通过跨膜蛋白synaptogyrin-3介导,与突触囊泡形成更稳定的相互作用。这种致病关联的结果可能使F-肌动蛋白聚集在突触前,并在物理上阻碍突触囊泡释放,导致神经传递减少。
Tau蛋白不是神经元存活所必需的,它在发育过程中作用并不重要,但Tau蛋白可以促进长期细胞存活功能,对神经元等非分裂细胞至关重要。Tau蛋白也可以引发一系列事件,导致神经元在生命后期死亡。迄今为止,已经鉴定出60多种Tau致病突变,约占所有额颞叶痴呆(FTD)病例的5%。突变按其在人类2N4R Tau中的位置编号。这些突变直接影响Tau翻译后修饰、蛋白质折叠和聚集,导致毒性功能获得,引起疾病。
参考文献
[1] Kolarova M, García-Sierra F, Bartos A, etal. Structure and pathology of tau protein in Alzheimer disease[J]. Int J Alzheimers Dis, 2012, 2012: 731526.
[2] Naseri NN, Wang H, Guo J, etal. The complexity of tau in Alzheimer's disease[J]. Neurosci Lett, 2019, 705: 183-194.
[3] 刘超, 闵苏.Tau蛋白的研究进展[J]. 临床麻醉学杂志, 2012, 28(5): 517-519.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302