液相色谱-串联质谱法检测25-羟维生素D标准化专家共识
中国老年保健医学研究会检验医学分会, 中国老年医学学会检验医学分会
中华检验医学杂志, 2021, 44(7): 587-595
临床血清维生素D检测方法主要为化学发光免疫分析法(chemiluminescent immunoassay,CLIA)和液相色谱-串联质谱法(liquid chromatography- tandem mass spectrometry,LC-MS/MS)。从检测原理出发,LC-MS/MS是基于被测生物标志物本身分子量、结构等化学性质的直接分析法,因此具有独特高灵敏度、高特异性和高通量特点。CLIA是基于抗原抗体反应,与LC-MS/MS相较,前处理简单且检测自动化程度高,但存在特异性低、线性范围窄和检测结果可比性差等问题。
目前LC-MS/MS检测25-羟维生素D[25(OH)D]的方法大多为实验室自建方法,虽然已有多类质谱检测试剂盒陆续上市,但方法缺乏标准化。另外,标准物质的缺乏或不适当使用、质量保证措施的不完整均可导致检测结果的偏差甚至错误。LC-MS/MS检测血清25(OH)D方法的标准化是其在临床实验室成功应用的必要条件,也是保证方法之间一致性和可比性的核心要素。本专家共识旨在建立标准化的血清25(OH)D检测方法,从标准物质和内标物的选择、仪器与试剂的准备、检测方法注意事项、质量控制管理、人员要求及参考区间等方面提出建议。
术语及定义
1. 25(OH)D:人体血液中维生素D的主要循环形式包括25(OH)D2和25(OH)D3,其中25(OH)D3为主要存在形式,因其稳定性好,可作为评价人体维生素D水平的可靠指标。
2. 内标:加入到待测样品中,作为测定待测组分含量的参照标准及其已知质量或含量纯物质。
3. 标准物质:具有足够均匀且稳定的特定特性物质,其特性适用于测量及标称特性检查的用途。
4. 有证标准物质:附有由权威机构发布文件,提供使用有效程序获得且具有不确定度和溯源性的一个或多个特性值标准物质。
5. 定量下限(limit of quantitation, LOQ):在规定的测量条件下,以指定的测量不确定度能测量的样品中可被测量的最低值。
维生素D主要代谢路径
人体维生素D主要来源于皮肤经阳光作用合成的维生素D3,另一种来源是食物中(如经光照后的蘑菇、野生海鱼等)的维生素D2,两者通过肝脏代谢后以2种形式存在,分别是25(OH)D2和25(OH)D3,虽然人体血液中超过95%的25(OH)D为25(OH)D3,但仍存在少量25(OH)D2,若补充外源性25(OH)D2,则体内可检测出浓度较高的25(OH)D2,因此需分别对25(OH)D2和25(OH)D3进行定量检测。25(OH)D在肾脏和其他组织中转变为具有生物活性的二羟基代谢物1,25-羟基维生素D[1,25-(OH)2D],该物质经过维生素D结合蛋白转运至靶器官,与维生素D受体结合,从而发挥其生理作用(图1)。1,25-(OH)2D在人体内的浓度低(pg/ml级别)、半衰期短,检测难度较大,而25(OH)D因其浓度高、稳定、半衰期较长,是反映机体维生素D代谢的重要检测指标。
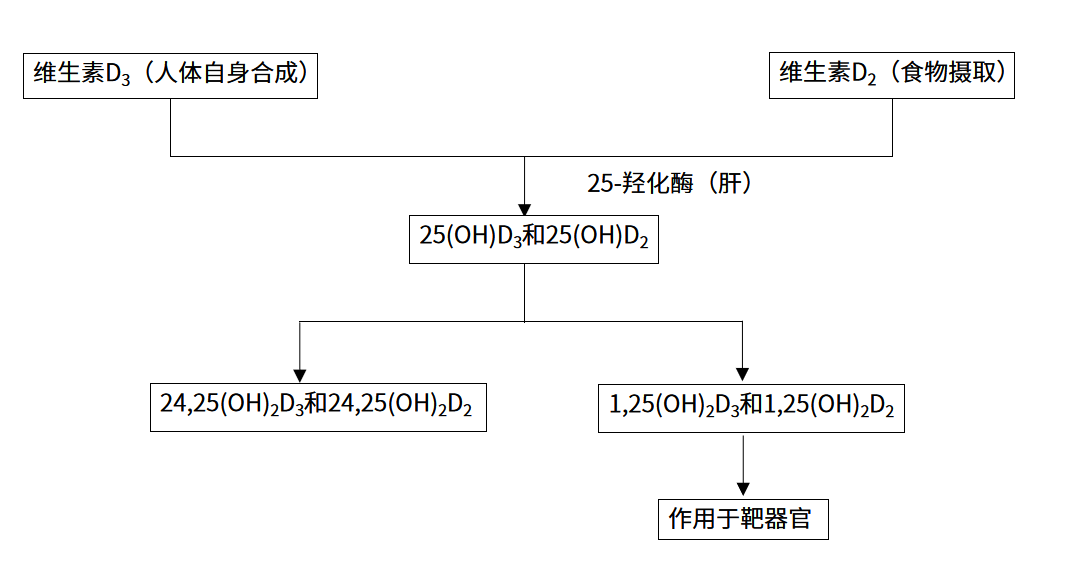
图1 维生素D代谢途径
LC-MS/MS技术
LC-MS/MS是通过质量分析器测定带电粒子质荷比的一种分析技术;MS/MS是将2个质量分析器由碰撞室串接起来的分析设备,即三重四极杆质谱仪。第一级质量分析器筛选出被离子化的样本中特定质荷比的母离子,母离子进入碰撞室,通过碰撞诱导解离的方式形成碎片子离子;第二级质量分析器筛选出特异性强的定量子离子及定性子离子,子离子进入检测器监测,最终得到目标分析物的含量。每个母离子/子离子对被称为1个离子对,只有具有特定离子对的待测物质,才能进入检测器。因此,MS/MS具有很好的检测特异性。此外,质谱方法具有同时监测多离子通道多反应监测(multiple reaction monitoring,MRM)的独特优势,即使在检测背景信号高的内源性化合物时,亦可通过同时监测2个离子碎片通道,实现待测物质的精准检测。
关键质量要素
1.标准物质的选择
具有溯源性的有证标准物质是实现量值溯源、检测结果准确一致的重要保证。应选用国家级权威机构有的证标准物质,若不可获得相关权威机构或国际公认的有证标准物质,则其他获得相关国家认可委员会标准物质生产者认可的提供明确溯源途径和测量不确定度的标准物质可作为替代选择。
表1 25-羟基维生素D标准物质信息
| 机构 | 标准物质 | 货号/编码 |
|---|---|---|
| 中国计量科学研究院 | 冰冻人血清中25-羟基维生素D标准物质 | NIM-RM3698-3700 |
| 美国国家标准和技术研究院 | 25-羟基维生素D校准溶液 | SRM 2972a |
| 冰冻人血清中维生素D代谢物 | SRM 972a | |
| 冰冻人血清中维生素D代谢物(高浓度) | SRM 2973 | |
| 美国Cerilliant公司 | 25-羟基维生素D2 | H-073 |
| 25-羟基维生素D3 | H-083 |
2.内标物的选择
1)内标物的作用
内标物可用于校正基质效应以及样本前处理、色谱分离和离子化过程引入的偏差,有助于提高定量分析的准确度和精密度。
2)推荐内标
推荐使用25(OH)D的稳定同位素标记物作为内标品,一般有:氘代或13C同位素内标。
3)内标物要求
内标物至少比目标分析物大3个分子量。内标物化学纯度≥98%,同位素标记纯度≥97%,如果低于该纯度,则其未标记的化合物浓度会与25(OH)D2或25(OH)D3的检测下限接近,导致检测结果系统性偏高。必要时应对内标物纯度进行测试,以避免其中含有与目标分析物共洗脱且具有相同质量数的干扰物质。
表2 可选内标品信息
| 机构或组织 | 内标品 | 产地 | 货号 |
|---|---|---|---|
| Iso Sciences | 25-羟基维生素D2-d3 | 美国 | 4176 |
| 西格玛-奥德里奇(Sigma-Aldrich) | 25-羟基维生素D2-d3 | 美国 | 705888 |
| 剑桥同位素(Cambridge isotope laboratories) | 25-羟基维生素D3-d6 | 美国 | DLM-7708 |
| 多伦多化学(Toronto Research Chemicals) | 25-羟基维生素D3-d6 | 加拿大 | C125702 |
| 曼哈格 BePure | 25-羟基维生素D2-d3 | 中国 | MD-0005 |
| 25-羟基维生素D2-d6 | 中国 | MD-0005D6 | |
| 25-羟基维生素D2-13C3 | 中国 | MC-0005 | |
| 25-羟基维生素D3-13C3 | 中国 | MC-0010 | |
| 25-羟基维生素D3-d3 | 中国 | MD-0010 | |
| 25-羟基维生素D3-d6 | 中国 | MD-0011D6 | |
| 贝塔医药 | 25-羟基维生素D2-d6 | 中国 | BTS-VD2-d6 |
| 25-羟基维生素D3-d6 | 中国 | BTS-VD3-d6 |
注:因25(OH)D2-d6[m+1]+(m/z 419)脱水形成的子离子(m/z 401)与25(OH)D3的分子离子峰[m+1]+(m/z 401)有相同质荷比,易与25(OH)D3特别是其异构体3-epi-25(OH)D3检测发生干扰,一般建议在使用氘代内标时选用25(OH)D2-d3作为内标。
3.样本前处理方法的选择
生物样本分析的主要障碍包括浓度低、干扰大、个体差异大等,样品处理目的主要是去除样品中的杂质,富集样品。针对血清25(OH)D的检测,如果仪器灵敏度高,蛋白沉淀法可作为首选的样品处理方法,具有耗时少,简单、经济等优点,但需要进行适当的色谱分离,以减少基质效应。固液萃取(solid liquid extraction, SLE)和固相萃取法(solid phase extraction, SPE)虽然可以去除样品的基质及富集样品,但其洗脱效率容易受到洗脱耗材批次差异的影响,需要进行不同厂家及不同批次的比对。
4.色谱条件选择
根据被测化合物的特性,进行流动相的优化,尽量避免使用非挥发性盐、无机酸、表面活性剂等流动相添加剂,尽量不用或少用极低浓度(< 0.02%)的流动相添加剂。此外,25(OH)D3与3-epi-25-羟基维生素D3[3-epi-25(OH)D3]为同分异构体。在学龄儿童体内,3-epi-25(OH)D3占25(OH)D的2.5%~17%,在出生后前3个月婴儿体内,3-epi-25(OH)D3浓度较高,占25(OH)D浓度的60%,在成人中占比较低,偶尔可高达22%。25(OH)D3与3-epi-25(OH)D3质荷比一致,导致无法通过质谱直接分离,一般可通过色谱分离的方式使这2种分析物具有不同保留时间;当分离度达到1.5时,可忽略3-epi-25(OH)D3对25(OH)D3检测的影响。如果需要进行3-epi-25(OH)D3的分离,则需确保色谱条件可以实现其与25(OH)D3的基线分离,参考谱图见图2。
-D2-and-25-(OH)-D3-detection-chromatograms.png)
图2 25(OH)D2和25(OH)D3检测色谱图
5.质谱参数选择
LC-MS/MS定量分析推荐一个分析物使用2个离子通道,分别作为定量离子通道和定性离子通道。25(OH)D2和25(OH)D3是水解代谢产物,热不稳定及离子化过程中也容易形成脱水子离子。需要注意的是其在基质中的背景噪音偏高,应避免选择脱水的子离子碎片(即母离子减少18的碎片离子)。但如果大气压化学电离源作为离子化模式,其在离子源中完全脱水形成稳定的脱水离子可以作为母离子。在任何给定时间内监测到的离子对通道越多,单个色谱峰可采集到的数据点就越少,如果用于表征色谱峰面积的数据点数量不足,数据的可靠性可能会受到影响,扫描时间单个色谱峰包含至少10个(建议15~20个)数据点。此外,优化离子通道内延迟时间,以避免碎片离子间发生交叉干扰。初步确定碰撞池电压和碰撞池能量后,建议使用提取样本进样以获得基质样本中最佳信噪比的碎片离子。
25(OH)D检测
1.试剂
(1)二类25-羟维生素D检测试剂盒:可溯源至可获得的最高级别标准物质。
(2)标准曲线:建议25(OH)D2的标准曲线范围至少包含2~100 ng/mL区间,25(OH)D3的标准曲线范围至少包含5~250 ng/mL区间,并且在选定的标准曲线范围内一般分散设置4~5个浓度点。
(3)质控样本:单独配制质控样本的初级工作液。质控样本基质应尽量和患者样本基质保持一致,以减小样本处理和离子化中的基质效应。建议配制2~3个浓度质控样本,浓度范围建议在临床参考区间的基础上(分布于正常和异常参考区间),结合分析方法的标准曲线综合设定,通常为标准曲线中3倍左右的LOQ、中间浓度±20%和70%~80%的定量上限,以确保不同浓度未知样本的准确性。
2.样本要求
本方法适用于新鲜、冷冻或冻干血清样本的25(OH)D2和25(OH)D3浓度检测。
3.参考区间
表3 不同文献规定的25(OH)D的临床参考区间
| 来源 | 正常 | 缺乏 | 不足 | 严重不足 | ||||
|---|---|---|---|---|---|---|---|---|
| ng/mL | nmol/L | ng/mL | nmol/L | ng/mL | nmol/L | ng/mL | nmol/L | |
| WS/T 677-2020人群维生素D缺乏筛查方法 | ≥20 | ≥50 | ≥12~<20 | ≥30~<50 | <12 | <30 | - | - |
| 维生素D及其类似物临床应用共识 | >30 | >75 | 20~30 | 50~75 | <20 | <50 | <10 | <25 |
注:“-”表示引文中无此项内容。
4.报告发布
根据《GB/T 22576.1-2018/ISO 15189:2012》进行检测结果的报告发布,报告前综合评估:质控是否在控,与此前结果是否一致,样本质量等因素进行综合考量。此外,建议各实验室报告单上分别显示25(OH)D2、25(OH)D3和25(OH)D的含量。
参考文献

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302