阿尔兹海默症病理机制假说
中华医学会神经病学分会痴呆与认知障碍学组
中华神经科杂志, 2022, 55(5): 421-439
阿尔茨海默病(Alzheimer's disease,AD)是一个连续疾病谱,包括临床前AD、AD源性轻度认知障碍(mild cognitive impairment,MCI)、轻度AD、中度AD和重度AD多个阶段;起病隐匿、早期诊断困难,导致认知障碍、精神行为问题和社会及生活功能丧失。AD主要病理学特征为Aβ沉积形成神经炎性斑块、Tau蛋白异常磷酸化形成的神经原纤维缠结(neurofibrillary tangles,NFTs)以及神经元缺失和胶质细胞增生等。AD漫长的临床前阶段出现于临床症状前10~20年,此时Aβ已开始在楔前叶和大脑皮质区域逐渐沉积,随后出现这些区域的低代谢、Tau病理和海马体积缩小等,最终表现为认知障碍。AD是涉及多种病理生理变化的慢性复杂疾病,病理机制假说多元化。
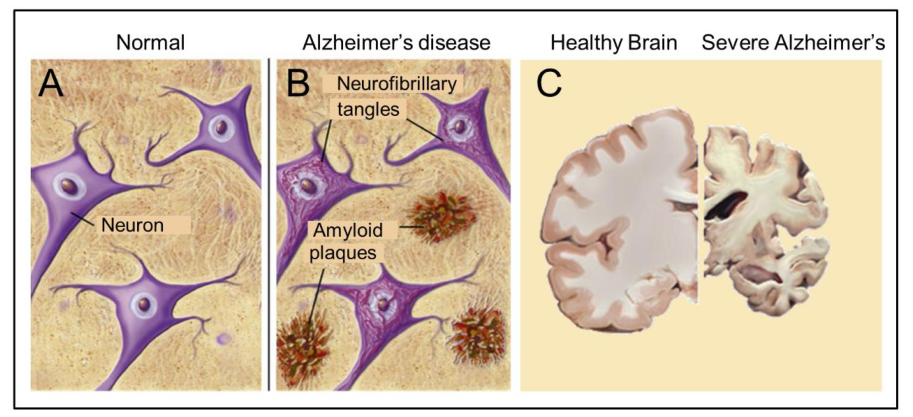
注:阿尔茨海默病的主要病理特征是淀粉样斑块和神经原纤维缠结(B),这在健康脑组织中是不存在的(A)。大量细胞凋亡发生在阿尔茨海默病发展的后期阶段(脑切片)(C)。
图1. 阿尔茨海默病的神经基础
Aβ寡聚体致病理论
Aβ的异常沉积是神经元变性的重要标志物。淀粉样蛋白假说最早由1991年Hardy和Allsop提出。沉积在海马和基底前脑的Aβ斑块会聚集更多的Aβ形成不溶性聚集物,诱发线粒体损伤,破坏系统稳态并导致突触功能障碍。值得注意的是,可溶性Aβ寡聚体比不溶性的Aβ原纤维和斑块更具毒性。可溶性Aβ寡聚体是导致AD发生一系列病理变化的起始因素,其机制之一是寡聚态Aβ损害了早期小胶质细胞的吞噬功能,导致小胶质细胞对晚期纤丝状Aβ的吞噬功能下降,同时诱发炎症级联毒性效应而损害神经元。
该假说认为,早发型家族性AD的主要致病基因是淀粉样前体蛋白(amyloid precursor protein,APP)、早老素1(presenilin 1,PS1)和早老素2(presenilin 2,PS2)基因突变,这些基因突变能增加Aβ的生成。晚发型散发性AD是复杂多基因相互作用导致的退行性疾病。ApoEε4等位基因是主要遗传危险因素,可使AD的发病风险增加4~10倍并使发病年龄提前,约50%的AD患者携带有ApoEε4基因。尽管该等位基因不影响Aβ的生成,但是能减少Aβ的清除,从而增加Aβ的总负荷,并参与Tau蛋白过度磷酸化等AD多个关键病理过程。
Tau蛋白过度磷酸化假说
1988年,Wischik等从AD患者大脑组织中分离出Tau蛋白,首次提出Tau蛋白可能是AD的病因之一。AD患者大脑中Tau蛋白的过度磷酸化导致构型改变,使其与微管蛋白聚合能力丧失,从而导致微管功能受损。大量游离在胞质中的Tau蛋白相互作用聚合形成不溶性的直丝(straight filaments)和双股螺旋细丝(paired helical filaments,PHF),最终导致NFT。NFT会减少突触的数量,产生神经毒性,引起细胞功能障碍。而可溶性Tau蛋白可能比NFT更有毒性作用,不仅有助于病理性Tau蛋白的传播,还可以影响神经变性和认知功能。
朊蛋白样传播假说
朊蛋白是一种由宿主编码的特殊构象的蛋白质,具有自我复制的能力、强大的感染力、顽强的生存能力以及保持隐蔽的能力。研究结果表明,Aβ通过类似于朊蛋白的机制在大脑中传播。注射到转基因小鼠大脑中的AD患者脑源性Aβ具有朊蛋白样表现,可诱导斑块形成和Aβ的广泛沉积。Tau蛋白也以朊蛋白样的方式在大脑和脊髓中传播。Tau蛋白水平与临床表现契合度更高,因为NFT的丰度与AD的脑萎缩程度和认知能力下降直接相关。
Aβ和脑血管异常的相互作用
血管危险因素在AD和MCI的发病机制中起着重要作用。AD早期病理生理上表现为脑血流量的减少,其原因可能是神经元损伤后代谢需要减少所致,也可能是血管危险因素或淀粉样血管病导致血管狭窄,进而引起血流量减少和区域性脑低灌注状态。它启动一系列病理生理级联反应,导致病情进展和恶化。MCI患者脑血管血流动力学的研究发现,在认知功能减退的早期阶段,患者的脑血管血流动力学和组织氧合参数均显著降低。脑血流量的降低不仅减少了必需养分向神经元的输送,还损害了脑组织对神经毒性代谢产物和蛋白的清除。这可能是加速Aβ沉积和Tau蛋白异常磷酸化的重要病理机制。
神经炎症假说
1988年,Rogers等从尸检病理发现AD患者脑皮质小胶质细胞被主要组织相容性复合体Ⅱ抗体所标记,表明人脑可能不是完全免疫豁免的器官。越来越多的研究结果显示神经炎症参与了AD的发病。一项荟萃分析结果显示,MCI患者病程伴随明显的炎性反应。肠道菌群失调可引起系统性炎性反应,破坏血脑屏障,在菌群异常代谢产物共同作用下触发神经性病变,如AD。通过分析MCI患者肠道菌群情况,发现在MCI阶段即出现菌群失调。肠道菌群的检测可能成为AD发病前的生物学标志物,提示“脑-肠轴”在AD发生、发展中的重要作用。在AD源性MCI患者的小规模队列研究中观察到了血浆苯丙氨酸和异亮氨酸浓度的升高以及血液中介导炎性反应的关键因子—Th1细胞的增加。在动物模型中,降低肠道菌群外周相关代谢产物苯丙氨酸/异亮氨酸的积聚,可减轻脑内神经炎症并逆转认知功能的损伤。
在过去的几十年里,对衰老和衰老相关疾病的生物化学和细胞生理学的研究,其中阿尔茨海默病是研究最多的一种,主要集中在脑源性蛋白的异常,特别是在细胞外斑块中的淀粉样蛋白-β(Aβ)肽沉积,细胞内聚集的Tau的神经原纤维缠结,以及突触功能障碍和神经元死亡。“神经原纤维缠结(NFT)”是过度磷酸化的Tau蛋白的聚集体,是阿尔茨海默病的主要标志。“淀粉样蛋白”是蛋白质的聚集体,而不是最初认为的“淀粉”或淀粉的聚集体。它们以某种方式折叠,使蛋白质的几个拷贝粘附在一起形成原纤维。淀粉样蛋白是由几种不同的蛋白质和多肽产生的。在细胞结构水平上,神经原纤维缠结和淀粉样斑块被认为是该病的相对“早期”标志物,而大量细胞凋亡则是较晚的标志物。

相关产品






