新型冠状病毒(2019-nCoV)结构及感染途径
2019新型冠状病毒(2019-nCoV)是一种新的冠状病毒,与SARS-CoV同属于网巢病毒目冠状病毒科的β-CoV,为一种不分节段的单股正链RNA病毒,其每组基因组长度约30000个核苷酸左右。与中东呼吸综合征冠状病毒(MERS-CoV)和严重急性呼吸综合征冠状病毒(SARS-CoV)不同,2019-nCoV是感染人类的冠状病毒家族中的第7个。从基因序列同源性上来说,2019-nCoV基因组与SARS具有80%的相似性,2019-nCoV与MERS-CoV的基因序列有40%的相似性。
2019-nCoV的结构
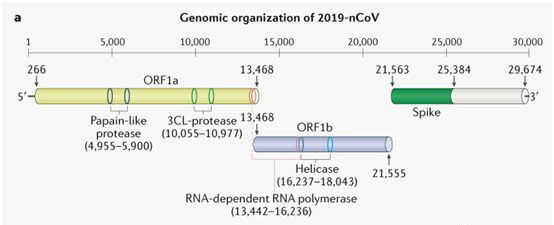
2019新型冠状病毒(2019-nCoV)表现出典型的冠状病毒属结构:5个未翻译区(UTR)、 复制酶复合体(orf1ab)、S基因、E基因、M基因、N基因、3个UTR,以及几个未识别的非结构开放阅读框。
S蛋白(Spike Protein)
S蛋白是冠状病毒表面最重要的膜蛋白。它有两个结构域组成。靠近N端的部分形成一个球形结构域,靠近C端的部分形成一个穿膜的棒状结构。研究表明,S蛋白和冠状病毒侵入细胞的过程密切相关。S蛋白前体在宿主的细胞质中合成以后会被切成两个部分,S1和S2。
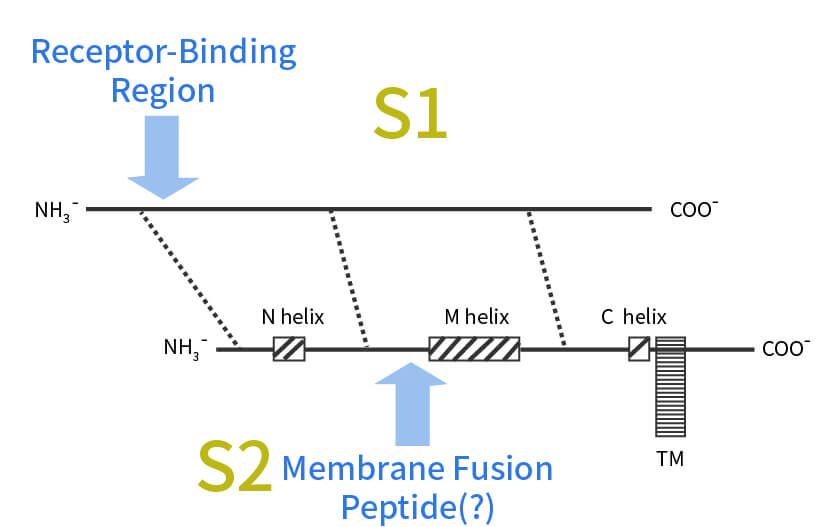
S蛋白前体两个切割产物的相互作用关系
其中S1形成成熟蛋白的球状部分,S2形成成熟蛋白的棒状部分,包括一个N helix,一个M helix,一个C helix和一个穿膜部分。S1和S2之间通过分子间相互作用力结合。S2的穿膜部分把整个S蛋白固定在病毒外壳膜上。
美国德克萨斯大学奥斯汀分校研究团队对新冠病毒的最新研究结果显示,新冠S蛋白约由1300个氨基酸组成,其被切割成的S1亚基约700个氨基酸,S2亚基约600个氨基酸,三个S1/S2异二聚体组装形成一个三聚体尖峰,从病毒包膜突出。其中,300多个氨基酸构成的受体结合区RBD是负责与宿主细胞受体结合的关键。
N蛋白(Nucleocapsid Protein)
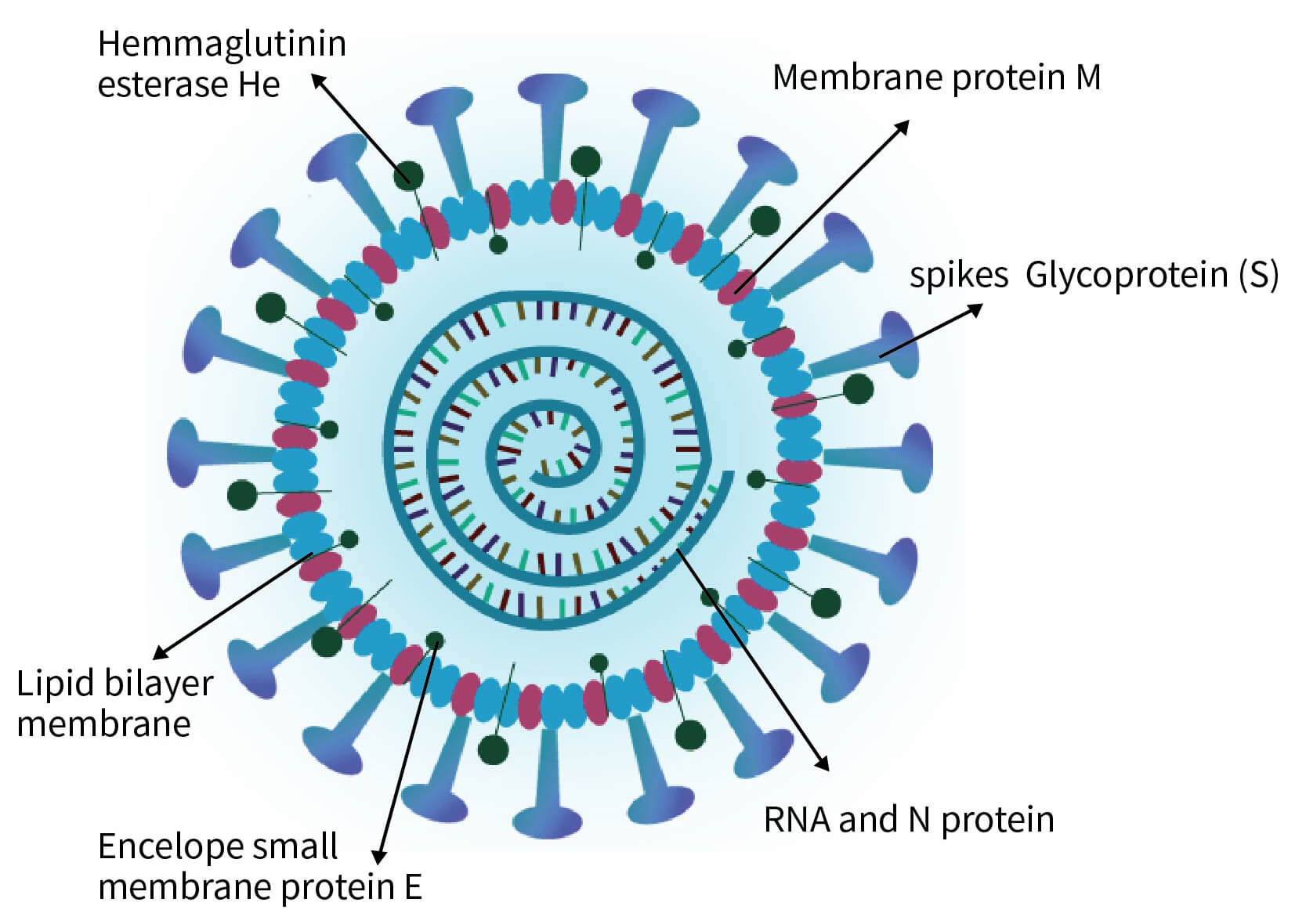
N蛋白是冠状病毒中另一种重要的结构蛋白。在冠状病毒颗粒中,N蛋白处于病毒颗粒的核心部分,以和Genomic RNA结合的形式存在。以前对鼠肝炎病毒的研究表明,N蛋白对于病毒基因组RNA特征序列的识别及其与其它结构蛋白的相互作用,对于病毒粒子的准确组装有着重要意义。
M蛋白和E蛋白
M蛋白是一种跨膜蛋白,它与S蛋白的结合,被认为是冠状病毒颗粒组装过程中的又一关键信号。
基因组分析
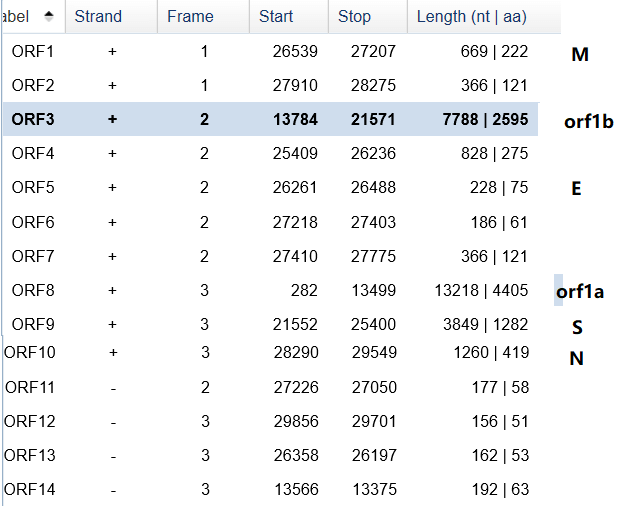
利用NCBI上的ORFfinder工具进行该病毒的基因组注释分析。
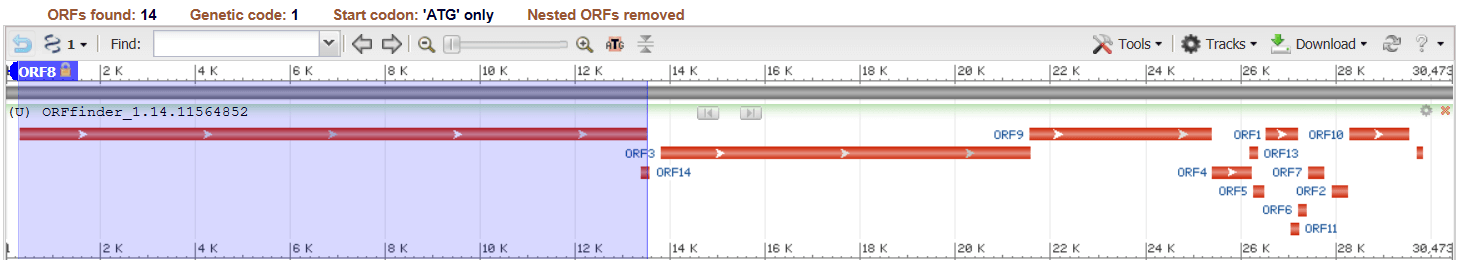
软件给出了14个主要的开放阅读框。下图中标明了orf1ab和四个主要结构蛋白的位置。
系统进化树的构建
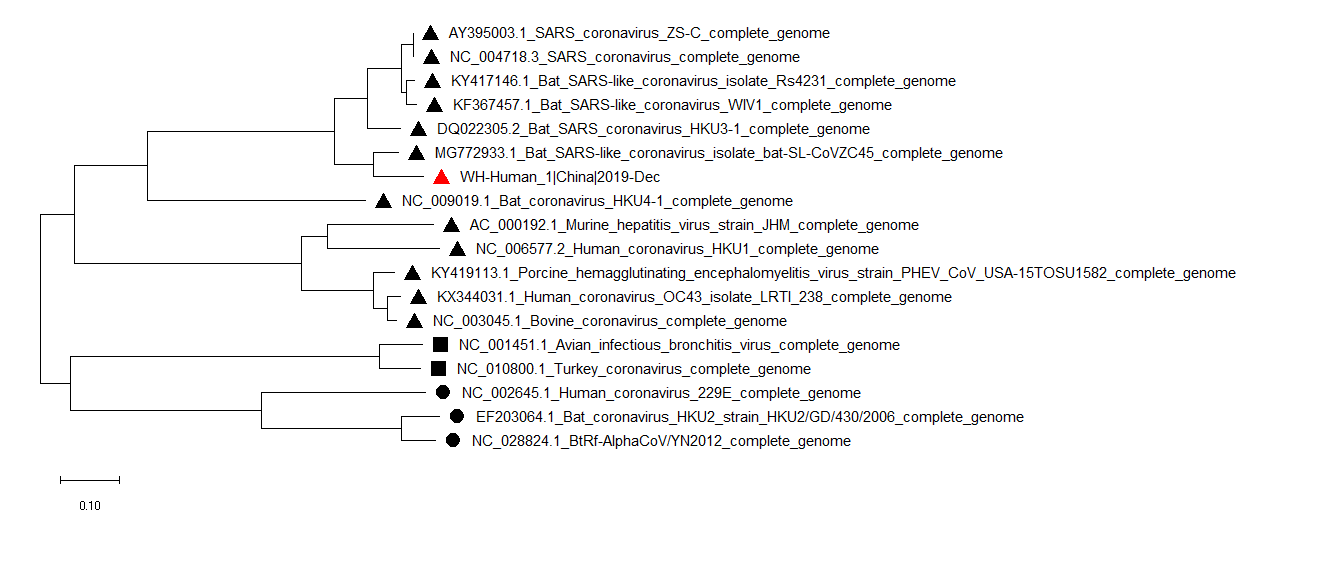
通过下载一系列相关的SARS-CoV、bat-SARS-CoV以及一些蝙蝠来源的α、β冠状病毒全基因组序列,通过MEGAX软件进行多重序列比对并构建了系统进化树。可以看到新冠病毒跟bat-SL-CoVZC45属于同一分支,但距离人源的SARS-CoV病毒较远。
2019-nCoV基因组编码非结构蛋白(比如3-胰凝乳蛋白酶样蛋白酶、木瓜蛋白酶样蛋白酶、解旋酶、RNA依赖性RNA聚合酶)、结构蛋白(比如刺突糖蛋白)和辅助蛋白。上面提到的这四种非结构蛋白是病毒生命周期中的关键酶,而刺突糖蛋白(spike protein)对于病毒进入细胞过程中的病毒-细胞受体相互作用是必不可少的。棘突蛋白包含2个亚单位:S1和S2。S1能够促进病毒与宿主细胞受体的结合,其含有一个重要的C端RBD结构域,正是这个区域负责和受体结合。新型冠状病毒RBD结构域的有一些基因区域与SARS有高度的同源性。其中SARS感染的5个关键位点中,有1个被新型冠状病毒保留,其余4个有氨基酸的替换和变化。2019-nCoV由于RBD结构域氨基酸变化,丢失了一些氢键作用,使得自由能上升,说明新型病毒结合能力要弱于SARS-CoV。 有研究表明,2019-nCoV 与严重急性呼吸综合征冠状病毒 (SARS-CoV) 密切相关,被认为与 SARS 具有相同的受体即血管紧张素转换酶 2 (ACE2),ACE2 在介导 2019-nCoV 感染中的作用已经得到证实。
2019-nCoV感染机制
与SARS相似,新型冠状病毒是通过S-蛋白与人ACE2互作的分子机制,来感染人的呼吸道上皮细胞。2019-nCoV能够识别血管紧张转化酶2(ACE2),通过棘突蛋白与ACE2结合再通过胞吞作用侵入细胞。ACE2为膜蛋白,在肺部细胞多有分布,病毒与ACE2结合后进入肺细胞,导致肺炎。S蛋白介导冠状病毒的入侵过程主要分为两个部分:
1、S蛋白识别并结合宿主细胞受体
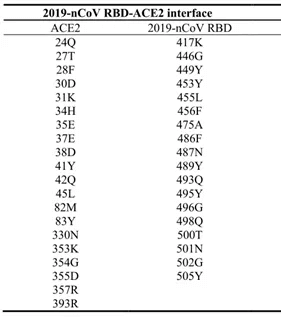
新冠状病毒通过S蛋白上受体结合域RBD与宿主细胞的受体ACE2结合,这是病毒感染的起始步骤。最近,发表在BioRxiv的文章“Crystal structure of the 2019-nCoV spike receptor-binding domain bound with the ACE2 receptor”中,作者利用X射线衍射技术,解析了2019-nCoV表面刺突糖蛋白受体结合区与人受体ACE2蛋白复合物的晶体结构,结构分析确定了2019-nCoV中对ACE2结合至关重要的残基,其中大多数是高度保守的或与SARS-CoV RBD中的残基具有相似的侧链特性。这种结构和序列上的相似性强烈支持2019-nCoV和SARS-CoV RBD之间会发生融合进化,从而改善与ACE2的结合,尽管它们被隔离在β冠状病毒属的不同遗传谱系中。
2、病毒与宿主细胞融合
当2019-nCoV RBD与细胞表面受体ACE2特异结合后,S2蛋白会发生构象变化,在宿主蛋白酶的切割下被激活,S蛋白构象发生改变,膜融合肽释放,插入到宿主细胞膜上,随后S2亚基上的两个七肽重复序列形成六螺旋束,拉近病毒包膜与宿主细胞膜之间的距离,进而促使病毒与宿主细胞融合,介导病毒的进入。
有研究表明,2019-nCoV与ACE2的亲和力是SARS与ACE2亲和力的10~20倍。当2019-nCoV Spike蛋白与ACE蛋白结合后,结合的5个氨基酸有4个发生了变化,但是整体上蛋白的构象并没有改变,因此2019-nCoV与ACE2具有很高的亲和力。

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302