血液中可溶性纤维蛋白与D-二聚体的形成及消除
在正常的止血系统中,血栓具有保护作用,是受损血管和组织再生的基质。为了防止纤溶系统过早破坏血栓,血栓与血流接触的表面会被纤维蛋白原(Fg)分子阻断。传染病、心血管疾病和肿瘤疾病等病理情况下,止血功能失调,血栓会参与疾病进程。
可溶性纤维蛋白(SF)是凝血系统激活的主要分子标志。SF以纤维蛋白-Fg复合物和短寡聚体的形式存在,其中desA纤维蛋白分子与因子XIIIa部分共价交联,其粘性末端被纤维蛋白原(Fg)分子阻断。在微循环条件下,纤维蛋白寡聚体可以与糖萼(glycocalyx)结合形成微凝块。微凝块表面会形成谷氨酸纤溶酶原(Glu-Pg)、纤维蛋白和t-PA的三元复合物,Glu-Pg被t-PA激活形成Glu-纤溶酶,溶解微凝块,产生D-二聚体(D-Dimer)。D-二聚体是凝血和纤溶过程激活的标志,它与血浆中纤维蛋白是各种疾病和手术中血栓并发症的重要预测标志物。
1.凝血与纤溶系统
止血系统的统一模型是凝血细胞和蛋白质因子参与血凝块的形成、溶解(图1)。止血系统的基础是凝血系统和纤溶系统。凝血系统包括多种血浆蛋白,如凝血因子、抑制剂以及血小板。纤溶系统包括Glu-Pg、t-PA酶原、α2-抗纤溶酶(α2-AP)和纤溶酶原激活抑制剂-1(PAI-1),负责清除血管壁上的纤维蛋白沉积物和血浆中的微凝块,在功能上与凝血系统相关。人们认为,凝血和纤溶解过程存在平衡(图2)。然而,实践表明,大多数与血栓形成和出血有关的病症可以通过纠正凝血系统紊乱而治愈,无需调节纤溶功能。此外,凝血和纤溶的激活是依次发生的,因此在心脏病发作、血栓栓塞和中风的情况下内源性纤溶系统的效果并不理想,即使延迟3小时使用超高浓度的纤溶药物(t-PA)也是无效的。
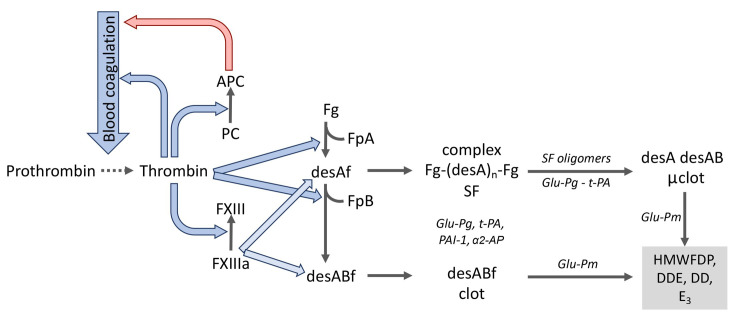
图1. 凝血激活、纤溶及蛋白C系统中的分子相互作用
注:Fg-纤维蛋白原;FXIII:纤维蛋白稳定因子XIII;FXIIIа:纤维蛋白稳定因子XIII的活化形式;PС:蛋白C;APC:活化蛋白C;FpA:纤维蛋白肽A;FpB:纤维蛋白肽B;desAf:纤维蛋白desA;desABf:纤维蛋白desAB;complex Fg-(desAn)-Fg:纤维蛋白原与纤维蛋白低聚物复合物;SF:可溶性纤维蛋白;desA desAB μclot :纤维蛋白desA和desAB凝块通过FXIIIa交联为毛细血管中的微凝块;α2-AP:α2-抗纤溶酶;PAI-1:I型纤溶酶原激活抑制剂;Glu-Pg:谷氨酸纤溶酶原;Glu-Pm:谷氨酸纤溶酶;HMWFDP:高分子量纤维蛋白降解产物;DD:D-二聚体;DDE:D-二聚体和E1片段的复合物;Е3:具有BβN结构域的E片段纤溶酶降解产物。
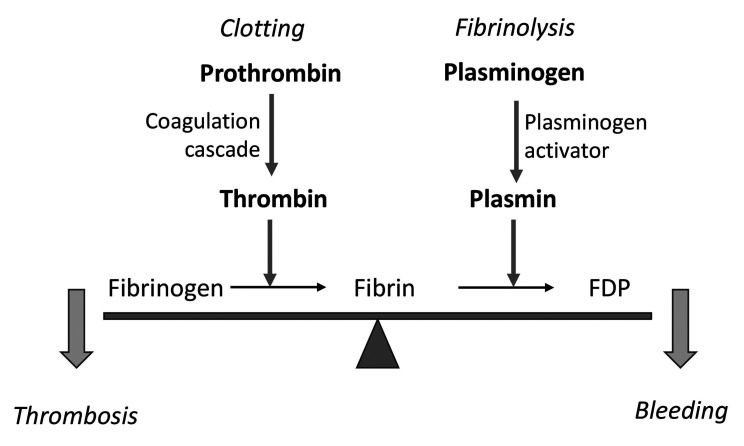
图2. 凝血及纤溶之间的平衡
2.纤维蛋白原(Fg)和可溶性纤维蛋白(SF)
2.1 Fg与SF的形成
血管和身体组织受损时产生的纤维蛋白形式与各种疾病时产生的纤维蛋白形式有显著差异。前者凝血酶在血管受损区域局部激活率高,血小板被激活,Fg迅速转化为desAB纤维蛋白网,局部强化血栓,封闭受损部位。在疾病状态下,特别是初期,凝血酶在全身缓慢地被激活,在以亚摩尔和纳摩尔浓度形成,导致Fg转化为极低浓度的desA纤维蛋白,高浓度Fg抑制desA纤维蛋白形成凝块,而是形成短纤维蛋白desA原纤维与Fg的复合物(称为SF)。病理状态下,SF可能会产生血栓。因此,血浆SF水平是止血系统状态的重要诊断指标,反映了止血系统病理过程的参与程度。
组成SF的纤维蛋白desA寡聚体由少于16个单体,通过A:a和C:c聚合位点相互作用形成。寡聚体的每条链沿γ链的C端与相邻纤维蛋白分子的D区通过FXIIIa部分交联。寡聚体的“粘性”末端与Fg分子结合,以终止进一步的伸长,并形成原纤维及微凝块。值得注意的是纤维蛋白desA寡聚体可以结合Glu-Pg和t-PA;但无法激活Glu-Pg,发生进一步降解。
2.2 Fg与SF的区别
SF寡聚体的结构与聚合纤维蛋白的原纤维结构有很大不同:
1)Fg浓度大大超过desA纤维蛋白浓度;
2)desA纤维蛋白分子中不存在B聚合位点;
3)desA纤维蛋白分子中存在αC区与BβN结构域的复合物。
2.3 Fg与SF的降解机制
原纤维和SF寡聚体的结构在体外降解的机制是相似的:首先,Glu-Pm裂解αC区,然后裂解分子E区BβN结构域的1-42片段。之后,它在铰链区依次裂解分子的α、β和γ链,从而形成终产物:D-二聚体、D和E3聚合纤维蛋白片段。仅8%的Fg分子中存在γ链,因此Fg形成的D-二聚体的浓度低于SF的浓度。
3.D-二聚体的形成
研究发现SF(正常条件下为3μg/mL,病理条件下为10-100μg/mL)和D-二聚体(正常条件下为0.05μg/mL,病理条件下为1-5μg/mL)的浓度差异很大,且不存在相关性。这表明SF和D-二聚体存在不同的调节机制。从理论上讲,D-二聚体可以来自被降解的SF。然而,研究发现:低聚形式的SF并不能活化Glu-Pg,必须先转化成微凝块(在微循环系统血管中形成),才能作为D-二聚体的来源。
在凝块中,谷氨酸纤溶酶分离出αC区后,裂解纤维蛋白分子铰链区的α、β和γ链,形成大片段聚合物纤维蛋白和最终产物DDE。DDE是D-二聚体的前体,DDE中E区B(β)N结构域的1-42个多肽片段进一步裂解,使复合物最终分解成D-二聚体和E3片段。
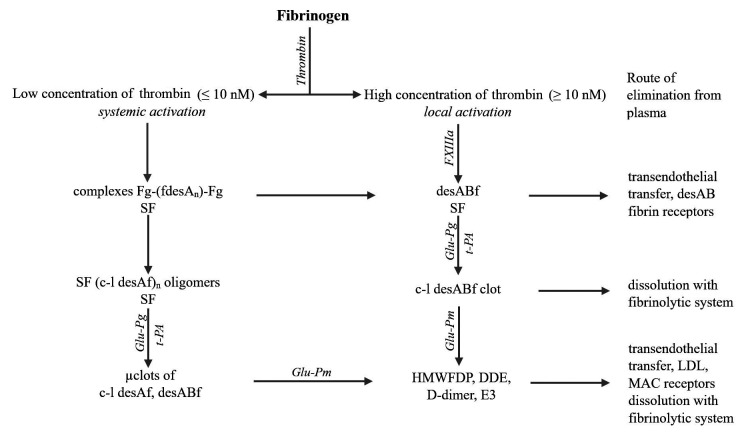
图3. SF、凝块和聚合纤维片段的形成、溶解及去除方式
注:desAf:纤维蛋白desA;desABf:纤维蛋白desAB;SF:可溶性纤维蛋白;Fg:纤维蛋白原;FXIIIа:纤维蛋白稳定因子XIII的活化形式;SF(c-l-desAf) noligomers:可溶性纤维蛋白交联desA寡聚体;complexes Fg-(fdesAn)-Fg:纤维蛋白原与纤维蛋白desA寡聚体复合物;c-l-desABf clot:血浆中循环的由FXIIIa交联的纤维蛋白desAB凝块;desAf μclot:由FXIIIa交联的纤维蛋白desA凝块作为毛细血管中的微凝块;HMWFDP:高分子量纤维蛋白降解产物;DDE:D-二聚体和E1片段的复合物;Е3:带有BβN结构域的E片段被纤溶酶降解后的产物;Glu-Pg:谷氨酸纤溶酶原;Glu-Pm:谷氨酸纤溶酶;t-PA:组织型纤溶酶原激活剂。
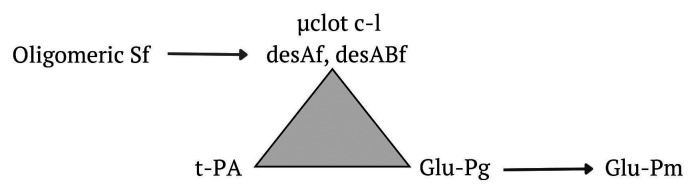
图4. FXIIIa聚合纤维蛋白非交联和交联纤维蛋白凝块的形成及降解
注:Oligomeric SF:低聚可溶性纤维蛋白;μclot c-l:毛细血管中FXIIIa交联的微凝块;desAf: 纤维蛋白desA;desABf:纤维蛋白desAB;t-PA:组织型纤溶酶原激活剂;Glu-Pg:谷氨酸纤溶酶原;Glu-Pm:谷氨酸纤溶酶。
4.SF与D-Dimer的临床意义
止血系统状态标志物的形成和消除存在不同的调节机制。作为血浆凝血和纤溶系统激活的指标,SF和D-二聚体的浓度存在显著差异,且没有相关性。SF参数提示了SF形成和激活凝血酶原转化的血液因子的早期表现。SF水平的稳定升高表明患者体内存在病理位点,需要进一步检查。D-二聚体参数则提示了导致血凝块形成的疾病进展,有助于早期预防性抗凝治疗。
5.结论
SF是凝血系统激活的标志物,寡聚形式的SF只有先转化为微凝块才能作为D-二聚体的来源。而D-二聚体是心血管系统中存在交联纤维蛋白沉积物的证据,以及纤溶系统破坏纤维蛋白沉积物的标志物,两者在功能上是相互关联的。此外,组织损伤期间和疾病期间纤维蛋白形成的机制明显不同。在组织损伤情况下,纤维蛋白在局部形成,并导致血栓形成;而在疾病情况下,Fg向纤维蛋白的转化在全身发生。全身纤维蛋白的形成使血浆中SF水平高于正常水平,这可能与其他病理因素一起造成血管内凝血的危险。
参考文献
Udovenko A, Makogonenko Y, Korolova D, et al. Formation and elimination of soluble fibrin and D-dimer in the bloodstream[J]. Croat Med J, 2023, 64(6): 421-429.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302