兔单克隆抗体开发技术研究进展
单克隆抗体由于其高特异性和亲和力而广泛用于治疗、诊断和生物学应用领域。目前,大多数针对人类抗原的单克隆抗体(mAb)是在小鼠体内产生的,小鼠单克隆抗体(MMA)已在诊断和治疗环境中得到广泛应用。然而,已经报道了使用MMA作为人类免疫治疗剂的许多弊端,包括血清半衰期短和诱导人类抗小鼠抗体反应。此外,许多人类免疫原无法刺激小鼠产生抗体反应。这些缺点限制了MMA在治疗和诊断应用中的使用。
与传统的MMA相比,兔单克隆抗体更适合用于研究和诊断。兔单克隆抗体表现出多种综合优势,包括对抗原的高亲和力、特异性、更多样化的表位识别,以及对小尺寸表位和小鼠抗原反应的大幅改善。此外,兔子在进化上与小鼠相距甚远,兔子可以针对某些在小鼠体内没有免疫原性的抗原产生抗体。这些优势使兔单克隆抗体成为人类疾病小鼠模型中极具吸引力的诊断试剂。与小鼠mAb类似,兔mAb也显示出一些局限性,包括在人类中诱导免疫原性。为了降低免疫原性并促进兔单克隆抗体用于治疗应用,嵌合化、人源化和Fc工程等抗体工程方法被成功应用。之前的两项研究表明,人源化兔单抗保留了对人类抗原的高特异性和亲和力,可用于诊断应用。此外,兔单克隆抗体和MMA对几种肿瘤类型的比较研究表明,兔单克隆抗体显示出更高的灵敏度,而没有明显的特异性损失。因此,兔免疫系统是产生针对人类抗原的治疗性人抗体的重要来源,兔单克隆抗体在药物和诊断中具有高亲和力和特异性的优势。随着抗体功能和库分析的进步,人源化兔单克隆抗体未来将在治疗应用中得到广泛应用。
独特的兔抗体库发育机制
兔免疫系统产生抗体多样性,并通过与小鼠和其他啮齿动物不同的机制优化亲和力。与传统鼠单克隆抗体相比,兔单克隆抗体在诊断方面具有优势,对抗原的亲和力和特异性高,表位识别更多样化,对小表位和小鼠抗原的反应大幅提高。兔免疫球蛋白重链(IGH)基因座包含200多个IGH可变种系基因,其中超过50%被发现是“无功能的”。此外,通过基因组测序(IMGT数据库)鉴定了超过50个IG Kappa V和17个IG Lambda V功能基因。大多数兔抗体源自IGHV1基因,虽然兔VH库的多样性有限,但VL库比小鼠和人类更多样化。兔VL库显示出比其人类和小鼠更长的互补决定区(CDR)-L3环。
最近,使用二代测序(NGS)技术分析了全面的兔抗体库。在这项研究中,发现IGHV1S40和IGHV1S45主导了幼兔的VH库,而IGHV1S69对用16聚体肽免疫的兔有显着贡献。此外,兔VH和VL的体细胞突变高于人类和小鼠,VH区域比人类和小鼠多三分之二的突变,而VL区域在片段区域(FR)-1和FR-3中积累的突变更多。兔CDR-H3的平均长度为12个氨基酸,与人类和小鼠相似,而CDR-L3的长度比人类和小鼠长得多。兔免疫系统同时使用基因转换和体细胞超突变来使抗体库多样化,与人类和小鼠相比,兔抗体库中的更多突变可以弥补用于构建功能库种系基因的限制。
兔单克隆抗体开发技术
单克隆抗体(mAb)是生物化学、分子生物学和医学研究中必不可少的工具。mAb疗法以越来越快的速度彻底改变了许多严重人类疾病的方法,在过去的十年中,已经开发出许多用于分离兔单克隆抗体的技术。
2017年初,超过230种mAb在阶段临床研究中得到评估。存在许多用于研究和治疗目的的mAb生成和鉴定方法。1975年Kohler和Milstein描述的小鼠杂交瘤方法是第一个也是最广泛使用的获得小鼠mAb的方法。在过去的几十年中,噬菌体展示、酵母表面展示、核糖体展示和mRNA展示技术已被用于生产mAb。尽管这些抗体生成技术被广泛用于mAb筛选,但这些方法效率低下且需要耗时的操作。此外,抗体的天然同源配对信息在展示方法中丢失,降低了抗体的特异性多样性。
最近,开发了一种基于单B细胞的方法,从单个B细胞或单细胞的克隆扩增后代直接取样免疫组库,避免了低效的杂交瘤融合步骤,并保留了天然的重链和轻链配对。此外,该技术利用了mAb的亲和力、特异性和稳定性特征的天然过程。通过FACS或手动显微操作从抗原特异性记忆B细胞或浆细胞,抗体基因被转移到原核、真核或无细胞表达系统中,表达重组兔单克隆抗体。单B细胞抗体技术平台已被证明是高效和稳健的,可以在短时间内从免疫兔中产生大量抗原特异性重组抗体,从而促进了兔单克隆抗体的生产。
1.杂交瘤技术
小鼠杂交瘤技术依赖于B细胞与骨髓瘤伴侣的细胞融合,自1975年被鉴定以来,广泛地用于小鼠单克隆抗体的生产(图1)。该方法采用免疫小鼠的淋巴细胞与源自BALB/c小鼠的骨髓瘤细胞融合,形成永生化杂交瘤细胞。然后,筛选杂交瘤细胞以鉴定产生相同抗体的特定克隆(图1)。兔单克隆抗体于1988年首次报道,采用小鼠-兔异源杂交瘤方法。然而,这种小鼠-兔异源杂交瘤效率相对较低、不稳定,并且无法长时间分泌抗体。在20世纪90年代中期,产生了稳定的兔-兔杂交瘤以生产兔单克隆抗体。这些兔-兔杂交瘤也被证明不如传统的小鼠杂交瘤稳定,这限制了它们在实验室水平上的广泛使用。此外,由于低效融合(传统聚乙二醇融合的效率为5×10-6)和转化事件,杂交瘤技术在兔单克隆抗体生产中的应用受到限制。
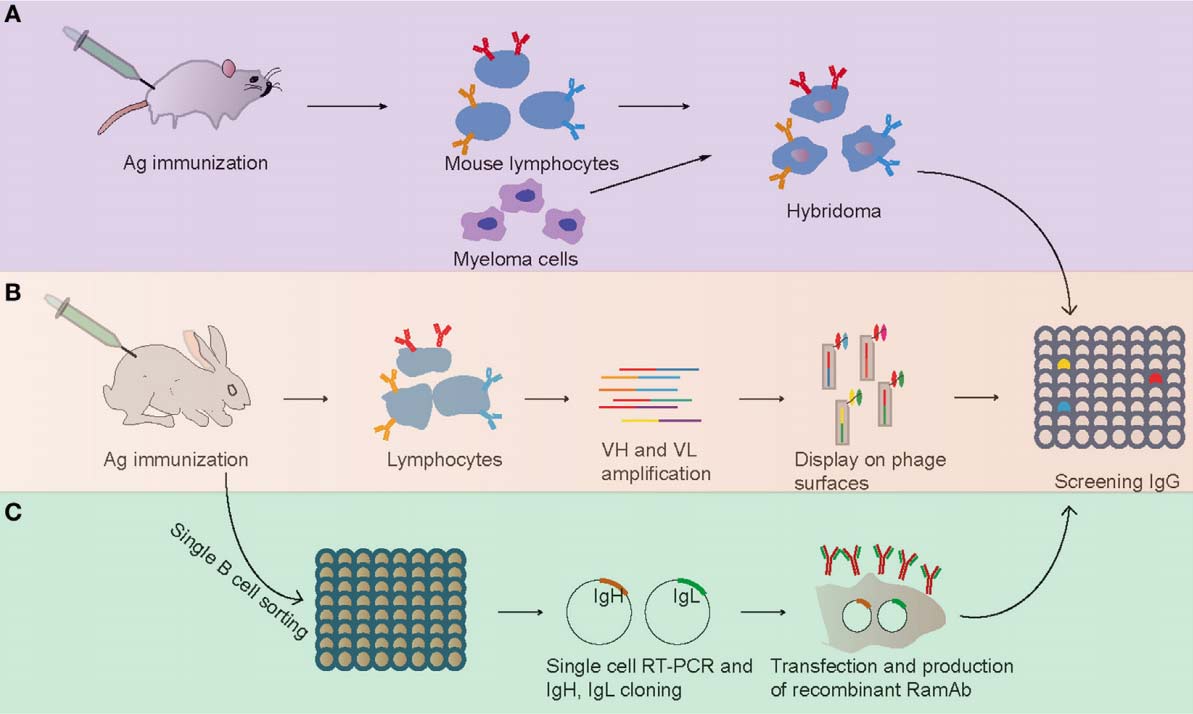
注:(A)小鼠杂交瘤技术;(B)噬菌体展示技术;(C)单B细胞抗体技术。
图1. 抗原特异性单克隆抗体开发流程
杂交瘤技术是一种成熟的小鼠单克隆抗体生成方法,广泛用于生产各种抗体。由于缺乏合适的骨髓瘤伴侣,杂交瘤方法主要限于啮齿动物免疫。在20世纪80年代,开发了一种用于生产治疗性抗体的人类杂交瘤技术,该技术允许以天然形式产生天然人类抗体。这种人类杂交瘤技术开发了另一种无需额外修饰即可产生治疗性抗体的有效方法。许多研究致力于这项技术,并发现了几种有用的人类融合伴侣细胞系。基于更好的融合伴侣的开发和电融合技术的进步,人类杂交瘤融合的成功率得到提高,这可以在不久的将来促进治疗性抗体的开发。此外,有一种基因修饰方法,通过过度表达BCL-6和BCL-XL使人类B细胞永生化。使用这项技术分离出了许多针对多种致病病毒的单克隆抗体。该技术还成功应用于其他物种,从永生化记忆B细胞中高效生成了兔单克隆抗体。
2.噬菌体展示技术
从1990年代初开始,噬菌体展示技术被探索为一种产生mAb的新方法。在这种方法中,从淋巴细胞中收集V基因库,并通过融合到丝状噬菌体的外壳蛋白来克隆和表达VH和VL的组合(图1)。然后,选择在其尖端带有表达的特定mAb的噬菌体颗粒并将其用于常规测定。与杂交瘤技术相比,噬菌体展示已成功用于筛选和分离免疫球蛋白基因。2000年,Rader等人。首先描述了用噬菌体展示技术筛选兔单克隆抗体的全过程。该技术成功地用于针对结肠癌免疫治疗的靶抗原人A33抗原的兔抗体的筛选和人源化,获得的人源化抗体对人A33抗原具有高度特异性和亲和力。目前,抗体噬菌体展示因其抗体生成速度快、易于制作以及体外控制各种选择参数的能力,成为了产生用于治疗目的的全人源抗体的主要技术平台。
基于对抗体结构、功能和序列多样性的了解,人类还开发了一种新的合成抗体库技术,并将其用于mAb生产,方法是将精确设计的序列插入抗原结合位点。这项技术是基于基因复制IgG片段和使用分子生物学技术在体外使抗体互补位多样化来实现的。几个具有多个可变重链和轻链框架区的合成抗体文库(例如HuCAL和Ylanthia文库)被设计并用于分离针对分子识别优化的人单克隆抗体。随着文库设计和选择方法的进步,合成抗体文库将成为快速生成具有高特异性的靶向结合单克隆抗体不可或缺的工具。
3.单B细胞抗体技术
尽管杂交瘤筛选和显示方法已用于兔单克隆抗体生产,但它们都存在一些缺点:杂交瘤技术细胞融合效率低,而展示方法导致重链和轻链的天然同源配对丢失。为了克服这些问题,最近开发了单B细胞抗体技术(图1)。简而言之,单B细胞抗体技术包括以下简短步骤:(i)通过随机方式或FACS从外周血或淋巴组织中鉴定和分离特定的单B细胞,(ii)单细胞逆转录-聚合酶链反应(RT-PCR)使用抗体特异性引物,(iii)使用PCR和测序扩增Ig基因,(iv)将Ig基因克隆到表达载体中,(v)Ig基因在细菌系统(例如大肠杆菌)中表达或哺乳动物细胞系统(例如HEK293、CHO细胞),以及(vi)纯化蛋白质并使用酶联免疫吸附测定法进行评估(图1)。这种方法已广泛用于人和小鼠单克隆抗体的生产,并产生了一些治疗性中和单克隆抗体,用于治疗多种疾病,包括癌症、自身免疫性疾病和传染病。例如,使用单B细胞抗体技术从HIV患者中分离出几种有价值的mAb用于临床诊断。这种方法最重要的优点是保留了重链和轻链的天然同源配对,利用抗体亲和力、特异性和成熟的自然过程。该技术有利于生成更高亲和力、特异性和稳定性的mAb。
记忆B细胞和浆/浆母细胞是产生抗体的主要来源。在人、小鼠和兔子的单B细胞抗体分析中采用的大多数方法都集中在记忆B细胞或浆/浆母细胞上。Kurosawa等人开发了一种基于内质网(ER)的方法,用于使用FACS和ER特异性荧光染料鉴定和分离抗原特异性血浆/浆母细胞。该方法提高了血浆/浆母细胞的选择效率,并消除了细胞繁殖和筛选过程。此外,Ozawa等人开发了一种芯片上的免疫斑点阵列测定技术来检测兔抗原特异性mAb,并且该技术可以产生特异性识别人转化生长因子-β-激活激酶1的磷酸化位点特异性表位的兔mAb。Clargo等人报道了一种基于荧光的方法与显微操作相结合,以分离兔单抗原特异性IgG分泌浆细胞,用于抗体表达分析。此外,Seeber等人使用淋巴细胞淘选捕获抗原特异性B细胞,结合体外B细胞短期培养和B细胞克隆,从外周血中分离功能性兔单克隆抗体。
兔淋巴细胞的分离由于缺乏有用的表面标志物而受到限制。为了选择稀有且特异性的兔B细胞进行mAb表达,开发了几种新方法。最近,Starkie等人描述了一种双色抗原染色法,用于鉴定抗原特异性兔记忆B细胞,有效抗体鉴定率为38.5%。在这项工作中,阴性细胞染色用于消除T细胞、幼稚IgM+B细胞和死细胞,使用抗IgG和双抗原标记步骤(FITC和PE)进行阳性细胞染色可以鉴定抗原特异性类别转化的IgG+记忆B细胞亚群。这种将FACS技术与抗原结合步骤相结合,提高了抗原特异性mAb的回收率,因此具有高通量。此外,还开发了另一种简单灵活的方法HybriFree,并成功用于小鼠、兔和鸡mAb的生产。HybriFree工作流程包括四个步骤:用装载抗原的固体基质捕获抗原特异性B细胞、VH和VL编码cDNA的单细胞扩增、在哺乳动物表达系统中构建组合VH-VL文库以及确定合适的VH-VL组合。该方法在10天内成功用于兔抗小鼠CD48单克隆抗体的高效制备,适用于任何抗体cDNA序列可用的物种。另一种用于兔mAb生产的称为“单细胞RT-PCR连接体外表达(SICREX)”的新型筛选平台。在这项工作中,通过显微操作结合抗原偶联磁珠分离抗原特异性B细胞,并使用线性Ig表达盒扩增Ig基因以实现无细胞生产。线性表达盒包含转录和翻译调控的所有必需元件,包括T7启动子和T7终止子,抗原结合片段或单链可变片段无需克隆即可表达。与之前的平台相比,SICREX的整个过程都是在体外进行的,将mAb生产时间缩短到几天。
最近,基于质谱(MS)的从头测序方法已被用于从血清来源的多克隆抗体库中鉴定纯化的mAb,这促进了血清Ig的蛋白质组学反卷积的发展。结合NGS和MS技术的进步,该方法成功地用于测定兔免疫后多克隆血清反应的抗体组成。在这种方法中,全长血清IgG被纯化并用胃蛋白酶处理以制备F(ab)2片段,然后抗原特异性F(ab)2分离片段并进行蛋白水解消化,用于液相色谱高分辨率串联质谱(LC-MS/MS)。同时,通过NGS测序构建抗体库数据。通过抗体数据库作图,鉴定出单个mAb。
参考文献
Zhang Z, Liu H, Guan Q, et al. Advances in the isolation of specific monoclonal rabbit antibodies[J].Front. Immunol, 8: 494.

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302