C反应蛋白(CRP)介绍
C反应蛋白(C-reactive protein,CRP)是一种急性时相反应蛋白,因最早发现其和肺炎球菌的C多糖相结合而得名。C反应蛋白是肝脏在身体发生急性感染、炎症时产生和释放的一种急性期反应物,可作为急性炎症标志物。
C反应蛋白的发现
1930年美国洛克菲勒研究院AVERY实验室的Tillett和Fransic发现急性感染患者的血清能和肺炎双球菌细胞壁上的C多糖发生沉淀反应。1941年,Avery等先后证实与C多糖发生反应的是一种急性感染时出现的蛋白质,该蛋白被命名为C反应蛋白。CRP是历史上最早被认识的急性时相蛋白。1950年CRP被纯化并形成结晶,用电子显微技术和X光射线衍射技术探索CRP蛋白结构,发现CRP是一种环状五聚体蛋白。
结构与生物学功能
C反应蛋白基因位于1号染色体q23,序列上高度保守.属于穿透素家族成员之一,相对分子质量为115-140kDa,由5个完全相同的单体组成,每个单体呈球体形(由206个氨基酸组成),他们相互以非共价形式构成对称的环状五球体(极少数蛋白具有这样的构型)。CRP沉降系数6.5-7.5,等电点为5.5,不易溶于水,结晶为菱形,可被硫酸铵沉淀。不耐热,60℃条件下30分钟即破坏。
正常状态下,CRP分子以五聚体形式存在,在酸性或碱性环境中也可分解为单体,从而引起某些免疫反应,但由于CRP单体存在于细胞膜而非血清中,故很难检测。
生物学功能
CRP序列高度保守,且其他动物类的CRP与人的氨基酸序列有惊人的相似性。因而,人们认为CRP是最保守的蛋白质,对物种的生存有重要意义。
CRP具有多种生物学功能,参与多种自身生理及病理生理过程。CRP与磷脂胆碱残基具有高度亲和力,并且可以和多种自身配体(如浆细胞脂蛋白、损伤细胞的细胞膜、小核糖体蛋白颗粒、调理素细胞等)或外来配体(如多聚糖、磷脂以及细菌、真菌、寄生虫等微生物的组分)相结合,CRP与这些配体结合后.被Clq识别。可以激活补体活化的经典途径。
近年来还发现CRP在血小板介导的细胞病毒中也发挥作用,一方面可能通过氧化的CRP激活血小板,另一方面CRP通过与血小板激活因子(PAF)的结合,已知PAF刺激血小板聚集及血小板膜释放花生四烯酸,抑制PAF诱导中性粒细胞结合,从而发挥其在炎症反应中的调节作用。
CRP合成与分布
合成:CRP在炎症、感染、组织损伤时通过IL-6、IL-2、TNF等细胞因子的刺激下合成。肝脏是其主要合成场所,另外在其它组织局部,如神经细胞、单核细胞、淋巴细胞及动脉粥样硬化斑块内可少量产生CRP。CRP在血中半衰期稳定,约19h,其浓度主要依赖于肝脏的生成量。
分布:CRP不能通过胎盘,在体内分布甚广,除血液外,胸水、腹水、心包液、关节液中均可测出。
C反应蛋白特点
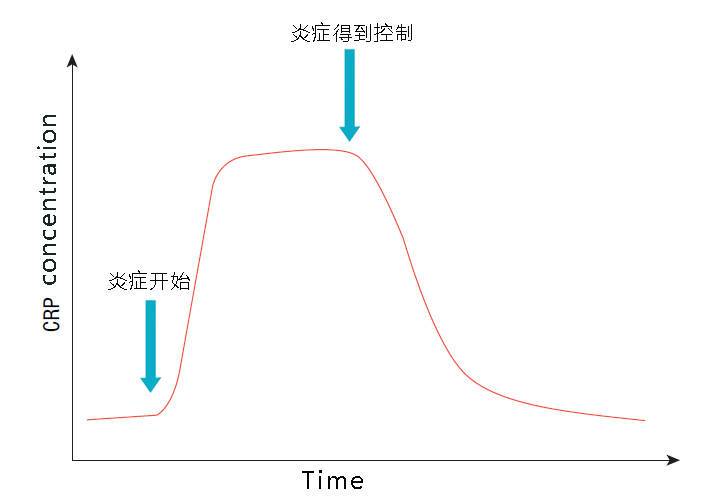
正常人血清中CRP的浓度很低(0.07~8.0mg/L,在健康人群中的浓度分布呈现明显的正偏态),在感染发生后CRP浓度显著上升,6~8h开始升高,24~48h达峰值,可升高至正常值的1000-2000倍,升高幅度与感染程度成正比。炎症治愈后浓度迅速下降,一周内可恢复正常水平。CRP在病毒感染时不会升高,其变化不受病人的个体差异、机体状态和治疗药物的影响。
超敏C反应蛋白
以往CRP的检测基于免疫透射比浊和免疫散射比浊方法,检测能力在3-5mg/L以上。近年来相继采用免疫增强比浊法等技术大大提高了分析的灵敏度(检测低限为0.05-0.10mg/L),这些方法所进行测定的CRP成为超敏C反应蛋白(High-sensitivity C-reactive protein,hsCRP)。
CRP作为炎症标志物,尽管为非特异性的,但对于细菌感染、各种炎症过程及组织坏死与损伤及其恢复期的筛检、监测、病情评估与疗效判断,都有重要的价值。CRP不仅是心血管疾病危险最有利的预测因子之一,而且对妊娠期糖尿病未来风险预测及临床治疗效果有效性评估,检测感染性疾病和心血管疾病最具有重要的临床应用前景。

相关产品



 苏公网安备32011202001302
苏公网安备32011202001302